|
4.7 Applikationsversuche
mit der eindimensionalen Verfahreinheit
4.7.1 Indol-3-essigsäure
Ob und wie Auxin bei Applikation in wässriger
Lösung am Hypokotyl wirkt, musste zunächst überprüft
werden. Die Aufnahmen mit dem OXALIS-System hatten bereits gezeigt,
dass äußerlich appliziertes IES die Circumnutationen
hemmt und eine Krümmungsreaktion auslösen kann. SANCHEZ-BRAVO
et al. (1991)
hatten jedoch beschrieben, dass nach Applikation von doppelt isotopenmarkiertem
IES am Kortex von Lupinus
albus die Radioaktivität unbeweglich
in der Nähe der Applikationsstelle verweilte. Sie schlossen
daraus, dass der polare Transport nicht im Kortex, sondern im Zentralzylinder
erfolgen muss. Markiertes IES, das in die Stele appliziert wurde,
wurde ähnlich rasch transportiert wie IES, das direkt auf dekapitierte
Hypokotyle gegeben wurde. Ihre Hypothese war, dass der polare Auxintransport
bei Lupinus albus
im Zentralzylinder erfolgt und von hier aus entlang eines Gradienten,
der möglicherweise durch die Metabolisierung des Auxins entsteht,
in die äußeren Gewebe gelangt. Dort wirkt es wachstumsfördernd.
Dass Auxin auch bei äußerlicher Applikation am Hypokotyl
von Arabidopsis thaliana
und Cardaminopsis
arenosa basipetal transportiert
wird, konnte an Hand von herablaufenden Krümmungen gezeigt
werden. Auch die Beobachtung, dass die Keimlinge nach seitlicher
Applikation von IES am oberen Hypokotyl einen Knick am unteren Ende
des Hypokotyls ausbilden, spricht dafür. Arabidopsis-
und Cardaminopsis-
Hypokotyle sind wesentlich kleiner als die Hypokotyle von Lupinus
albus. Es ist anzunehmen, dass
IES bei äußerlicher Applikation an Arabidopsis
und Cardaminopsis
wesentlich rascher in die inneren Bereiche des Hypokotyls diffundieren
kann als bei Lupinus.
Ob IES in Arabidopsis-
und Cardaminopsis-
Hypokotylen ausschließlich im Zentralzylinder transportiert
wird, wurde bislang nicht untersucht. Aber auch ein Transport kleiner
Mengen von Auxin direkt in der Epidermis oder direkt darunter liegenden
Zellschichten ist denkbar. Dieser wäre die Voraussetzung für
Circumnutationsmodelle, die auf peripher herablaufenden Auxinströmen
basieren.
Welche Rolle Indol-3-essigsäure
bei der Transduktion von gravitropen und phototropen Reizen des
Hypokotyls spielt und ob die Cholodny-Went-Theorie (CHOLODNY, 1926;
WENT, 1926) zutrifft, ist weiterhin umstritten. Eine Übersicht
zu den physiologischen Grundlagen von Streckungswachstum, Auxintransport,
Perzeption und Transduktion von gravitropen Reizen gibt SCHUSTER
(1996).
Wie bereit erwähnt, hatte SCHUSTER
(1996) die gravitrope Reaktionszeit bei Hypokotylen von Cardaminopsis
arenosa im schwachen Weißlicht
bestimmt. Sie betrug 20,6 Minuten (Durchschnitt aus 12 Pflanzen).
In diesem Zusammenhang schien es interessant, die Reaktion und Reaktionszeit
von lokal am oberen Hypokotyl von Cardaminopsis
arenosa appliziertem IES zu ermitteln.
Es ergab sich ein Wachstumsschub nach 18,9 Minuten (Durchschnitt
aus 7 Pflanzen, Abtastintervall eine Minute).
Die Statolithentheorie (BJÖRKMAN,
1988) beschreibt, dass gravitationsbedingt von Statolithen Kräfte
auf Sensoren in speziellen Zellen (Statocyten) wirken. Bei höheren
Pflanzen werden seit langem Amyloplasten als Statolithen diskutiert
(HABERLANDT, 1902). Bei Wurzeln wurde beschrieben, dass es nur 12
bis 20 Sekunden dauert, bis sich die Amyloplasten absetzen (IVERSEN
und LARSEN, 1973). Bei Gräsern setzen sich Statolithen in den
Zellen der (falschen) Pulvini in weniger als zwei Minuten ab (SALISBURY
und ROSS, 1992). Die gravitrope Reaktionszeit bei Cardaminopsis
arenosa ist mit 20,6 Minuten nur
knapp zwei Minuten länger als die Reaktionszeit nach Applikation
von IES. Der Zeitunterschied könnte unter anderem durch die
Dauer des Absinkens von Statolithen verursacht worden sein.
Die phototrope Reaktionszeit von Arabidopsis
thaliana C24 entspricht mit etwa
24 Minuten ebenfalls der Reaktionszeit nach Applikation von IES.
Die Vermutung liegt nahe, dass IES sowohl an der Transduktion der
phototropen als auch der gravitropen Reaktionen beteiligt ist.
Applikation von ein bis zwei µl
5 µM IES-Lösung an Hypokotylen im Schwachlicht bewirkte
neben einem Wachstumsschub meist ein Erlöschen von Circumnutationen.
Vermutlich kommt das System in eine Sättigung, wenn hohe Dosen
IES verabreicht werden. Einige Stunden nach Auxingabe setzen wieder
Schwingungen ein. Zwischenzeitlich könnten die großen
Auxinmengen aus der Schwingungszone abtransportiert worden sein.
In einem Versuch wurde im Abstand von etwa 20 Minuten je ein µl
5 µM IES-Lösung appliziert. Die zweite Applikation bewirkte
keine weitere Steigerung der Wachstumsgeschwindigkeit. Dies unterstützt
die Vermutung, dass bereits die einmalige Gabe der IES-Lösung
eine Sättigung bewirkt. Weitere Applikationsversuche mit unterschiedlichen
Auxinkonzentrationen könnten diese Annahmen bestätigen.
Seitliche Applikation von IES bewirkte
meist eine Krümmungsreaktion. Es kam jedoch auch vor, dass
die Hypokotyle danach nur rascher wuchsen, ohne sich zu krümmen.
Hier diffundierte möglicherweise so viel Auxin transversal,
dass es sich auf den gesamten Hypokotylquerschnitt auswirkte.
Circumnutationen liefen während
der Krümmungsreaktionen und Wachstumsschübe, die durch
geringe Mengen von IES verursacht wurden, meist weiter. Hier könnte
sich die Wirkung von äußerlich appliziertem Auxin mit
der Wirkung von inneren Auxinströmen oder auch anderen Faktoren,
die im Zusammenhang mit Circumnutationen stehen, überlagern.
Wurden niedrig konzentrierte IES-Lösungen
appliziert, kam es gelegentlich zu einer kurzfristigen, reversiblen
Krümmungsreaktion, die anscheinend nicht mit einem Wachstumsschub
einher ging. Möglicherweise bewirkt IES hier keine irreversible
Zellverlängerung. Stattdessen könnten sich die Zelllängen
durch Turgoränderungen vorübergehend geändert haben.
Mit der dreidimensionalen Verfahreinheit
sind weitere Aufnahmen zur Ausbreitungsgeschwindigkeit von Auxin-induzierten
Krümmungen geplant. Zusätzlich sollte gemessen werden,
in welche Richtung und wie rasch sich radioaktiv markiertes IES
in den Hypokotylen ausbreitet. Ein Vergleich der Transportgeschwindigkeit
von IES mit der Ausbreitungsgeschwindigkeit der IES-induzierten
Krümmung am selben Organismus könnte Hinweise auf die
Mechanismen liefern, die den Circumnutationen zugrunde liegen. Wenn
die Synchronisation von Zelllängenänderungen bei Circumnutationen
durch herablaufende Auxinströme erfolgt, sollten beide Geschwindigkeiten
übereinstimmen. Aber auch andere Arten der Informationsübertragung
zwischen Nachbarzellen, beispielweise durch osmotische oder elektrische
Phänomene (vgl. GRADMANN und BUSCHMANN, 1996) wären denkbar.
Die Applikationsversuche von Pufferlösungen hatten gezeigt,
dass verschiedene Ionen einen starken Einfluss auf die Circumnutationen
haben können.
4.7.2 NPA
Nach JENSEN
et al. (1998) wird das Wachstum
von Arabidopsis thaliana
Hypokotylen im Licht durch NPA kräftig gehemmt. Im Dunkeln
wird die Elongation jedoch nicht beeinflusst. Die gravitrope Reaktion
wird durch NPA jedoch unabhängig von den Lichtbedingungen unterbunden.
Bei
Cardaminopsis arenosa wurde das
Wachstum im mittleren Weißlicht (Photonenstrom 15 µmol
m-2 s-1) schwach, im schwachen Weißlicht (1,75 µmol
m-2 s-1) nicht gehemmt. Bei Arabidopsis
thaliana wurde das Wachstum in
manchen Fällen jedoch auch im Schwachlicht (1,75 µmol
m-2 s-1) gehemmt. Hier scheint es Unterschiede zwischen beiden Arten
zu geben. Bei Arabidopsis
thaliana streuten die Ergebnisse
stark. JENSEN et al.
hatten NPA dem Nährmedium zugesetzt. Bei meinen Versuchen war
die Substanz lokal am Hypokotyl appliziert worden. Möglicherweise
variiert hier die Aufnahme von NPA durch die Kutikula und Epidermis
von Individuum zu Individuum. Es konnten nur wenige Versuche durchgeführt
werden. Weitere Untersuchungen zur Wirkung von lokal appliziertem
NPA auf das Wachstum beider Arten sind geplant.
Circumnutationen wurden durch NPA ausgelöscht,
sofern die Substanz in oder oberhalb der Schwingungszone appliziert
wurde. Dies unterstreicht die These, dass Auxin an der Entstehung
von Circumnutationen beteiligt ist. In einem Fall konnte beobachtet
werden, dass die Circumnutation oberhalb der Applikationsstelle
weiter ging, nachdem NPA im mittleren Bereich der Schwingungszonen
gegeben wurde. Im Verlauf von etwa zwei Stunden beschränkten
sich die Schwingungen auf immer weiter oben liegende Teile des Hypokotyls,
um schließlich ganz aufzuhören. Dies könnte so interpretiert
werden, dass sich allmählich immer mehr Auxin in den Zellen
oberhalb der Applikationsstelle ansammelte, was zu einem Erlöschen
der Schwingungen führte. Es handelt sich dabei jedoch um ein
Einzelergebnis und weitere Versuche wären nötig. Eine
Echtzeitauswertung würde erlauben, NPA gezielt im schwingenden
Bereich des Hypokotyls zu applizieren.
Die Wirkung von lokal appliziertem NPA
auf die phototrope Reaktion wurde bislang nicht untersucht. FUJITA
und SYONO (1997) isolierten und charakterisierten die Arabidopsis-Mutante
pis1.
Sie reagiert mit einem weiten Spektrum von Effekten wie Wachstum
von Hypokotyl und Wurzel, Wurzelgravitropismus und Wurzelphototropismus
hypersensitiv auf NPA. Ein genetischer Faktor ist zuständig,
der sowohl Gravitropismus als auch Phototropismus kontrolliert.
Die Ergebnisse zeigen, dass der Auxintransport bei beiden Tropismen
eine Rolle spielt. Wie erwartet, war bei meinen Versuchen die phototrope
Reaktion von mit NPA vorbehandelten Arabidopsis-Keimlingen
schwächer als die der unbehandelten Kontrollgruppe.
Im Zusammenhang mit den Untersuchungen
zur Wirkung von NPA auf den Phototropismus wurde auch der zeitliche
Verlauf der phototropen Reaktion untersucht. Dabei zeigte sich,
dass sich die Pflanzen in den ersten 2,5 Stunden nach Beginn eines
seitlichen Blaulichtpulses immer stärker auf diese Lichtquelle
ausrichteten. Danach folgte eine leichte Aufwärtsbewegung und
anschließend eine neuerliche stärkere Ausrichtung auf
das seitliche Blaulicht. Bei der Avena-Koleoptile
ist bekannt, dass, abhängig von der Reizmenge, auf die erste
positive phototrope Reaktion eine negative und danach weitere positive
und negative Reaktionen folgen können.
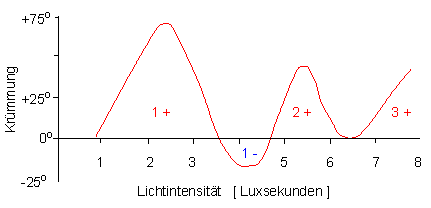
Abbildung 4-3:
Dosis-Effekt-Kurve des Phototropismus
etiolierter Avena-Koleoptilen
(schematische Darstellung). Die Lichtdosis (Weißlicht) wird
in Luxsekunden angegeben; auf der Ordinate ist die positive, bzw.
negative Krümmung aufgetragen. Die Reaktionsbereiche der ersten,
zweiten und dritten positiven, sowie der negativen Krümmung
sind in der Kurve vermerkt (nach SENGBUSCH, 2001).
Vermutlich herrschen bei Arabidopsis-Keimlingen
ähnliche Verhältnisse. Hier kommt es jedoch zu keine negativen
Krümmung sondern lediglich zu einem Rückgang und Wiederanstieg
der Krümmung in Abhängigkeit von der Reizmenge oder Reizdauer.
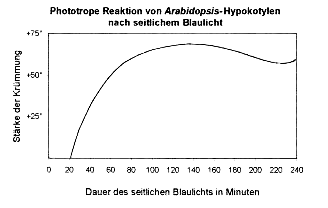
Abbildung 4-4: Phototrope
Reaktion von Arabidopsis-Hypokotylen
auf einen vierstündigen seitlichen Blaulichtpuls (schematische
Darstellung). Die Keimlinge krümmen sich anfangs immer stärker.
Danach richteten sie sich allmählich wieder etwas auf. Schließlich
folgte eine erneute Zunahme der Krümmung.
4.7.3 Cycloheximid
SCHUSTER (1996) hatte das circadiane
Schwingungsverhalten von Cardaminopsis
arenosa bereits untersucht. Er
fand für das Auftreten von Schwingungsphasen eine durchschnittliche
Periodenlänge von 26,2 Stunden. Die Standardabweichung betrug
1,9 Stunden. Für SCHUSTER war es schwierig, Wachstumsschübe
als Zeiger der circadianen Rhythmik zu benutzen, da er mit seiner
Apparatur immer nur einen oder wenige Keimlinge gleichzeitig registrieren
konnte. Mit der eindimensionalen Verfahreinheit konnten jedoch -
abhängig vom gewünschten Zeitabstand der scans - bis zu
25 Pflanzen gleichzeitig registriert werden.
KARAKASHIAN und SCHWEIGER (1976) fanden
Hinweise auf eine Cycloheximid-sensitive Komponente im circadianen
Oszillator der Grünalge Acetabularia.
Der circadiane Rhythmus wird offensichtlich nicht von Transkription
oder Translation der Chloroplasten und Mitochondrien beeinflusst,
sondern von der Translation an cytoplasmatischen Ribosomen. WOLLNIK
et al.
(1989) fanden eine Phasenverschiebung der circadianen Uhr beim Hamster
(Mesocricetus auratus)
nach Injektionen von Cycloheximid. Stärke und Richtung der
Phasenverschiebung hingen von der circadianen Zeit ab. Ihre Ergebnisse
unterstützten ebenfalls die Hypothese, dass die 80S-ribosomale
Proteinsynthese eine wichtige Rolle im biochemischen Mechanismus
circadianer Systeme spielt. JOHNSON und NAKASHIMA (1990) beschrieben,
dass die lichtinduzierten Phasenverschiebungen der circadianen Uhr
beim Schimmelpilz Neurospora
crassa durch Cycloheximid gehemmt
wurde. Das war nicht der Fall bei Mutanten, deren Proteinsynthese
gegen Cycloheximid resistent war. Wurden Licht und Cycloheximid
gleichzeitig zu verschiedenen circadianen Phasen gegeben, bestimmte
immer Cycloheximid die Phasenverschiebung.
Die Wirkung von Cycloheximid auf die
circadiane Rhythmik des Hypokotylwachstums wurde bislang nicht untersucht.
Da das tagesperiodische Wachstum bei Cardaminopsis
länger anhält als bei Arabidopsis,
wurden Versuche an Cardaminopsis
durchgeführt.
Es ist bekannt, dass der Proteinsynthesehemmer
Cycloheximid das Längenwachstum von Wurzeln hemmt (BASKIN und
BIVENS, 1995). Auch eine hemmende Wirkung auf das Hypokotylwachstum
wurde gefunden. CHO und HONG (1995) beobachteten bei mit IES behandelten
Helianthus-Hypokotylsegmenten
eine etwa fünffache Steigerung der Wachstumsrate und der H+-Exkretion
innerhalb von zwei Stunden. Das Wachstum von Segmenten, die 60 Minuten
zuvor mit IES behandelt worden waren und eine maximale IES-induzierte
Elongationsrate aufwiesen, wurde nach kurzer Zeit (weniger als 10
Minuten) durch Cycloheximid gehemmt. Auch RNA-Synthesehemmer (Cordycepin),
Calcium-Kanal Blocker (Verapamil), und Sekretionsinhibitoren (Monensin
and Brefeldin A) reduzierten die Wachstumsrate deutlich.
Bei Cardaminopsis
arenosa dauerte es durchschnittlich
30 bis 60 Minuten und in Einzelfällen sogar länger, bis
die lokale Applikation von Cycloheximid am oberen Hypokotyl einen
Wachstumsstop bewirkte. Die starke Streuung ist möglicherweise
darauf zurückzuführen, dass es bei den einzelnen Keimlingen
unterschiedlich lange dauerte, bis die Substanz den Wirkungsort
erreichte. Cycloheximid wirkt vermutlich nur, wenn es die Zellen
des oberen Hypokotyls, die sich gerade strecken, erreicht. Applikation
am unteren, nicht mehr wachsenden Hypokotyl sowie an den Kotyledonen
wirkte in der Regel nicht. Ob und wie die Substanz im Organismus
verlagert wird, ist nicht bekannt. Die Dauer der CHX-Wirkung ist
möglicherweise vom Applikationszeitpunkt abhängig. Hierzu
müssten jedoch noch weitere Versuche durchgeführt werden.
Der Wachstumsstop nach Cycloheximidbehandlung
(100 µM bis 1mM, 1-2 µl) bewirkte eine Phasenverschiebung
des circadianen Wachstums. Die Daten lassen vermuten, dass die neue
Phasenlage durch das Ende der CHX-Wirkung bestimmt wird. Möglicherweise
wird die innere Uhr durch Cycloheximid angehalten oder zurückgesetzt
und kommt erst mit dem Ende der CHX-Wirkung wieder in Gang.
Kleinere Mengen von lokal appliziertem
Cycloheximid beeinflussten das Wachstum nicht erkennbar. Ob und
wie die circadiane Rhythmik davon beeinflusst wird, wurde nicht
untersucht. Bei längeren Registrierungen mit der eindimensionalen
Verfahreinheit wuchsen die Pflanzen häufig aus den Bildern
heraus. Durch Tiefersetzen der Pflanzen konnte der obere Bereich
dann weiter registriert werden. Die Auswertung ist jedoch schwierig,
da einzelne Versuchsteile manuell zusammengesetzt werden müssen.
Die dreidimensionale Verfahreinheit wäre für solche Aufnahmen
besser geeignet.
|