|
3.5 Simulation des Hypokotylwachstums Um verschiedene Hypothesen über die Vorgänge beim Wachstum und bei Circumnutationen von Hypokotylen zu überprüfen, wurde ein Simulationsprogramm entwickelt. Mit Hilfe simulierter Pflanzen sollten außerdem die Funktion und die Ergebnisse der eigenen Auswertemethoden bei realen Pflanzen geprüft und kritisch betrachtet werden. Das Simulationsmodell bestand aus mehreren Programmen und shell-skripten, die Funktionen zur Dateneingabe, Berechnung und Datenausgabe beinhalteten. Um Variablen im Programm zu ändern, wurde jeweils der Quelltext des Berechnungsprogramms "cs" editiert. Durch Aufruf des Simulationsskripts "cellsim" unter Angabe der Zahl der zu simulierenden Schritte und möglicher weiterer "Schalter" wurde der Quelltext jeweils neu kompiliert und die Simulation lief ab. Die Ausgabe des Simulationsprogramms erfolgte in grafischer Form. Bei den Aufnahmen von echten Keimlingen waren in periodischen Zeitabständen (scans) Bilder von zwei etwa im rechten Winkel auf die Pflänzchen blickenden Kameras angefertigt worden. Analog dazu wurden im Modell für jeden scan zwei Bilder generiert, die den momentanen Zustand des modellierten Organismus aus dem Blickwinkel der jeweiligen "Kamera" zeigten. Diese Bilder wurden wie bei den echten Aufnahmen unter einer fortlaufenden Nummer abgespeichert und mit einem Zeit-Label versehen, das ihrem virtuellen Aufnahmezeitpunkt entsprach. Die künstlich generierten Bilder konnten genau wie die echten Bilder mit dem Auswerteskript "aus" ausgewertet und das Ergebnis mit dem Videoplayer "v2" betrachtet werden. Die meisten Aufnahmen von realen Pflanzen waren in Zeitabständen von 4 Minuten erfolgt. Auch bei der Simulation wurden "Aufnahmen" im Abstand von 4 Minuten angefertigt. Die interne Berechnung der Wachstumsvorgänge erfolgte jedoch im Abstand von 10 Sekunden. Das Simulationsmodell ging von der Annahme aus, dass die Elongation der Zellen in der Epidermis den zentralen Faktor im Circumnutationsgeschehen darstellt. Daher wurde ein schlauchförmiges Gebilde aus einzelnen, nebeneinander und übereinander liegenden "Zellen" simuliert. Bei den echten Keimlingen waren im Infrarotlicht lokale Helligkeitsunterschiede durch Reflexionen an der Kutikula und durch unterschiedliche Lichtdurchlässigkeit und Färbung darunter liegender Zellbereiche zu erkennen. Diese Helligkeitsunterschiede resultierten in einem mehr oder weniger zufälligen Hell-Dunkel-Muster, das andeutungsweise mit Zellen und Zellgrenzen assoziiert war. Um dies nachzuempfinden, wurde den einzelnen "Zellen" am Anfang der Simulation ein zufälliger Grauwert zugewiesen. Diesen Grauwert behielten die "Zellen" bis zum Ende der Simulation bei. Als Sonderfunktion besaß das Programm die Möglichkeit, die momentane "Auxinkonzentration" der einzelnen "Zellen" grafisch darzustellen. Bei dieser Variante wurde den "Zellen" kein zufälliger Grauwert zugewiesen, sondern ihre Helligkeit wurde proportional zu ihrem "Auxingehalt" codiert. Dies geschah in skalierter Weise, d.h. die "Zelle" mit dem höchsten "Auxingehalt" bekam den Grauwert 255 zugewiesen (100% weiß) und die "Zelle" mit dem niedrigsten "Auxingehalt" besaß den Wert 0 (100% schwarz). Zum Aufruf dieser Sonderfunktion musste die Option "h" gesetzt werden. Um beispielsweise 1000 Schritte unter Darstellung der lokalen "Auxinkonzentration" zu simulieren, musste das Programm mit "cellsim 1000 h" gestartet werden. Auch andere Parameter wie z.B. die Elongationsfähigkeit der "Zellen" konnten auf die Zellfarbe abgebildet werden. Diese Funktionen wurden jedoch nur in Arbeitsversionen eingeführt. Das "Hypokotyl" bestand aus konzentrischen Ringen von "Zellen". Mehrere solcher "Zellringe" lagen übereinander. Die Anzahl der "Zellen" in einem Ring und die Zahl der übereinander liegenden Zellringe wurden als Variablen gehalten und konnten den Verhältnissen bei unterschiedlichen Organismen (Arabidopsis, Cardaminopsis etc.) angepasst werden. Diese und andere Voreinstellungen wurden im Skript "mkcell" jeweils vor Beginn einer Simulation festgelegt. Das Skript "mkcell" beinhaltete folgende Parameter: ROWS= Zahl der übereinander liegenden
"Zellringe" Als zentraler biochemischer Faktor im Wachstumsgeschehen wurde "Auxin" postuliert. Die Mengen von "Auxin" in einer "Zelle" war entscheidend für den Grad ihrer Elongation in den folgenden Simulationsschritten. In der Regel erfolgte die Einspeisung von "Auxin" in die oberste Zellreihe des simulierten Organismus. Dies trägt der Beobachtung Rechnung, dass die Hauptmenge von Auxin vom Apex und von den Kotyledonen synthetisiert wird. Außerdem konnte man "Auxin" zu beliebigen Zeitpunkten in einzelne "Zellen" des simulierten Organismus einspeisen. Damit wurde es beispielsweise möglich, einmalige, pulsförmige, lokale Applikationen von "Auxin" in einzelne "Zellen" oder "Zellgruppen" zu simulieren, was einer externen Applikation von Auxin am lebenden Organismus entsprach. Diese Funktionen wurden jedoch nur in Arbeitsversionen des Programms implementiert. "Auxin" wurde in jedem Simulationsschritt in einem festen Prozentsatz von einer "Zelle" in die darunter liegende "Zelle" weitergeleitet. Der Prozentsatz dieses "polaren Auxintransports" AUXIN_DOWN war variabel und wurde im Programm "cs" definiert. Eine weitere Variable war die Auxinmenge QANTAUXIN, die einen Bezugswert für die Größe der verschiedenen eingespeisten "Auxinmengen" darstellt. Entsprechend den Verhältnissen bei realen Pflanzen entfaltete "Auxin" auch in der Simulation seine Wirkung erst nach einer gewissen Zeitverzögerung. Im Regelfall dauerte es ca. 40 Minuten, bis die "Auxinwirkung" einsetzte. Daraufhin hielt sie für etwas eine Stunde an, um danach wieder abzuklingen. Zu Simulationsbeginn wurde allen "Zellen" im Skript "mkcell" die ungefähr gleiche minimale Länge von z.B. 2,2 Pixeln zugewiesen (zufallsgesteuert). Die Variable MAXLEN im Programm "cs" definierte ihre maximale Länge in Pixel im voll elongierten Zustand. Neben basalem "polarem" Auxintransport wurde auch die Möglichkeit eines lateralen Auxintransports vorgesehen (AUXIN_TO_LEFT und AUXIN_TO_RIGHT). "Auxin" wurde dabei in jedem Simulationsschritt in einem festen Prozentsatz von einer "Zelle" in die horizontal benachbarte "Zelle" weitergeleitet. Die Summe von AUXIN_TO_LEFT, AUXIN_TO_RIGHT und AUXIN_DOWN durfte 100 (%) natürlich nicht übersteigen; eine Summe von 100 bedeutete, dass die gesamte Auxinmenge einer Zelle im nächsten Simulationsschritt in die anderen Zellen verschoben würde - ein eher unrealistischer Fall. Bei natürlichen Hypokotylen strecken sich im Verlauf des Wachstums die unteren Zellen zuerst. Dann elongieren nacheinander immer mehr darüber liegende Zellen, bis der Organismus schließlich seine Maximallänge erreicht hat. Dieser Vorgang setzt voraus, dass sich die einzelnen Zellen ihrer räumlichen Lage im Hypokotyl "bewusst" sind. Sie müssen ihr Wachstum entweder mit darunter liegenden Zellen koordinieren oder ihr Wachstumsverhalten muss in irgend einer Weise zeitlich gesteuert sein. Beide Möglichkeiten wurden in zwei unterschiedlichen Ansätzen simuliert. 3.5.1 Simulation des "Zellwachstums" abhängig von der Länge darunter liegender "Zellen" In diesem Simulationsansatz war die Elongationsfähigkeit
einer "Zelle" direkt vom Elongationszustand der direkt
darunter liegenden "Zelle" abhängig. Die Elongationsfähigkeit
einer Zelle wurde entsprechend dem auf die maximale Elongation (MAXLEN)
bezogenen Elongationszustand der darunter liegenden Zelle vermindert.
Eine "Zelle", die über einer bereits voll elongierten
"Zelle" lokalisiert war, streckte sich deshalb in einem
Simulationsschritt wesentlich stärker als eine "Zelle",
die sich über einer wenig oder nicht elongierten "Zelle"
befand. Für die "Zellen" der untersten "Zellreihe"
wurde festgelegt, dass ihre Elongationsfähigkeit maximal war
und somit der Elongationsfähigkeit von über voll elongierten
"Zellen" lokalisierten "Zellen" entsprach. Um den Fehler zu korrigieren wurde eine neue Variable (ELON_KONST) eingeführt. Diese Variable subtrahierte bei der Berechnung eine Konstante von der Anfangslänge der "Zelle". Setzte man die Konstante gleich der Anfangslänge der "Zellen", lieferte das Modell das erwartete Ergebnis. Die sehr schmale Elongationszone, in der immer nur etwa drei übereinander liegende "Zellen" gleichzeitig sichtbar elongierten, entsprach nicht den natürlichen Gegebenheiten. Wurde ein solcher Versuch ausgewertet, ergaben sich nur eine ausgesprochen kleine, im Zeitverlaufsbild der Auswertung kaum sichtbare Elongationszone. Deshalb wurde in der nächsten Programmversion die Elongationsfähigkeit der "Zellen" nicht nur vom Elongationszustand der direkt darunter liegenden "Zelle" abhängig gemacht. Hier ging vielmehr die Länge einer variablen Anzahl (LENACTLEN) von darunter liegenden "Zellen" in einer gewichteten Funktion in die Elongationsfähigkeit der betreffenden "Zelle" ein. Als weiterer Parameter konnte mit LENACTATT die Abnahme der Gewichtung angegeben werden. Sinnvolle Angaben lagen hier zwischen null und eins, wobei bei null keine der darunter liegenden Zellen berücksichtigt wurde (sämtliche Gewichte = Null) und bei eins die Länge der darunter liegenden Zellen komplett in die Berechnung der aktuellen Zelllänge einging. Wurden LENACTLEN und LENACTATT beide auf eins gesetzt, ergab sich dann wieder die zuvor aufgeführte Programmversion, in der nur die Länge der direkt darunter liegenden Zelle vollständig in die Berechnung der neuen Zelllänge eingegangen war.
Folgende Parameter konnten im Programm "cs" gewählt werden: ELON_BREITE: Breite der Elongationszone in
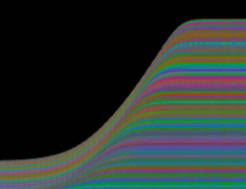
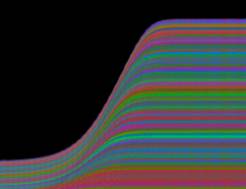
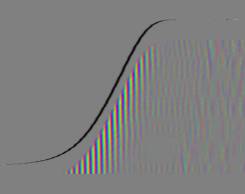
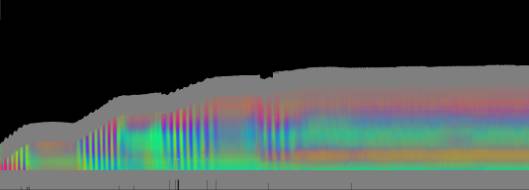
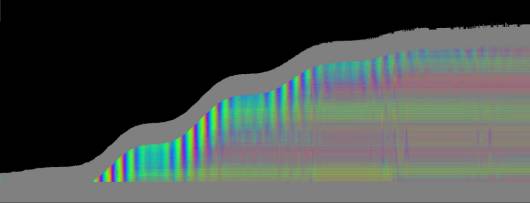
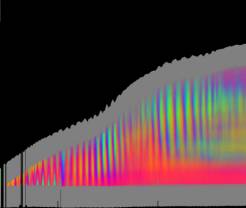
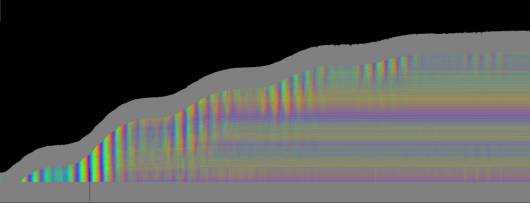
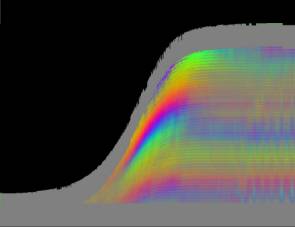
Zellen Je nach Zahl der Zellen im Organismus mussten diese Parameter angepasst werden, um realistische Bilder zu erhalten. Da "Auxin" in der obersten "Zellreihe" eingespeist und nach unten weitergereicht wurde, dauerte es stets eine gewisse Zeit, bis es die untersten "Zellen" erreichte. Die untersten "Zellreihen" durften natürlich auch erst zu diesem Zeitpunkt von der Elongationszone erreicht werden. Dies gelang indem man durch geeignete Wahl von ELON_LAGE die Lage der Elongationszone zu Simulationsbeginn nach unten verschob. Ansonsten blieben die untersten "Zellen" kleiner als die darüber liegenden. 3.5.3 Simulation von Circumnutationen Um Circumnutationen zu simulieren, wurde das Modell einer zyklischen Anregung gewählt. Hierzu wurde die in den obersten "Zellen" injizierte "Auxinmenge" mit 1+sin x über den "Zellring" moduliert. Im ersten Simulationsschritt erhielt die "Zelle" bei 0° also genau eine Einheit "Auxin", die "Zelle" bei 90° zwei Einheiten "Auxin", während die in die "Zelle" bei 270° eingespeiste "Auxinmenge" gerade Null war. Die so modulierte Anregung konnte mit variabler Periodenlänge EXCIT_PER über den obersten "Zellring" gedreht werden. Außerdem war es möglich, die Lage der Anregung zu Simulationsbeginn zwischen 0° und 360° zu variieren (EXCIT_PHA). Die Betrachtung der so generierten Bildserien mit dem Videoplayer "v2" lieferte typische kreisförmige Wachstumsbewegungen, wie sie bei echten Pflanzen auch beobachtet werden konnten. Wurden die Simulationsdaten mit den gleichen Methoden analysiert die bei den echten Pflanzen verwendet worden waren, ergaben sich abermals ähnliche Ergebnisse. Ein wichtiger Punkt der vorliegenden Arbeit war es, die Frage zu klären, ob Circumnutationen durch herablaufende Auxinpulse oder Auxinströme zustande kommen können. Das Simulationsmodell einer zyklisch umlaufenden Injektion von "Auxin" in die oberste "Zellreihe" entspricht einer umlaufenden Auxinproduktion im Apex von realen Pflanzen. In der Simulation wird beispielsweise zum Zeitpunkt t0 "Auxin" in die "Zelle" bei 0° eingespeist. In jedem Simulationsschritt wird ein Teil des "Auxins" in die darunter liegende "Zelle" transportiert. "Auxin" bewirkt eine Verlängerung der betreffenden "Zellen". Es kommt zu einer Krümmung des "Hypokotyls" in Richtung der gegenüberliegenden Seite der betreffenden "Zelle". Die Elongation weiter unten liegender "Zellen" ist in Phase mit der Elongation oberer "Zellen", jedoch aufgrund der Wanderungsgeschwindigkeit des "Auxins" zeitverzögert, je nach Abstand zum obersten "Zellring". Im Zeitverlaufsfenster der Auswertung liefern solche Schwingungen daher leicht schräge farbige Banden, die von links oben nach rechts unten verlaufen. Dabei ist es unerheblich, ob die "Circumnutation" im Uhrzeigersinn oder im Gegenuhrzeigersinn verläuft. Die Neigung der Bande ist lediglich abhängig von der Wandergeschwindigkeit des "Auxins". Je langsamer "Auxin" nach unten transportiert wird, desto langsamer breiten sich die Krümmungen nach unten aus. Entsprechend stark sind die Banden geneigt. Ähnliche Zeitverlaufsbilder kamen auch bei realen Pflanzen vor:
Abbildung 3-72: Arabidopsis thaliana, Stamm C24 im LD 0800-2400: drei Ausschnitte aus dem Zeitverlaufsbild. Deutliche Neigung der farbigen Banden von links oben nach rechts unten. Versuch At990607_4_x9
Bei echten Pflanzen verläuft das Wachstum in tagesperiodischen oder circadianen Schüben. Auftreten, Häufigkeit und Intensität der Schwingungen stehen in engem Zusammenhang mit den Wachstumsschüben. In Phasen geringen Wachstums werden die Schwingungen in der Regel schwächer oder bleiben ganz aus. Daneben beobachtet man eine Verlängerung der Schwingungsperiode mit zunehmendem Alter der Pflanzen. Im Modell wurde die diurnale Wachstumsrhythmik
durch tagesperiodische Modulation der "Auxinmenge" QANTAUXIN
simuliert. Es wurde zudem vorgesehen, die Amplitude der "Auxinmenge"
über die Zeit exponentiell abnehmen lassen zu können.
Außerdem war es möglich, die Phasenlage der Wachstumsgipfel
bezüglich des Startzeitpunkts der Simulation zu verschieben. DIUR_HALBW Halbwertszeit der Dämpfung
der 24-h Schwingung in Tagen Die Modulation der Anregung erfolgte gemäß folgender Gleichung: quantauxin =QANTAUXIN*(1+DIUR_X*sin((v-DIUR_LAGE)*2Pi)*e-v/(DIUR_H*ln2) mit v = simtime / 3600 / 24 Die Zeitverlaufsbilder der Auswertung simulierten Wachstums ähnelten den echten Aufnahmen durchaus. Um die Animation
zu starten klicken Sie bitte auf das Player-Symbol der gewünschten
Version
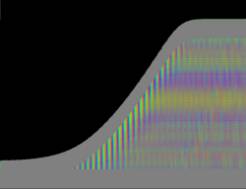
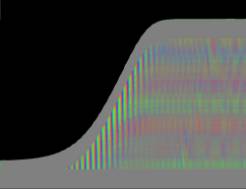
Das "Wachstum" erfolgte bei der Simulation in tagesperiodischen Schüben wie bei realen Pflanzen. Genau wie dort waren in Phasen geringen Wachstums auch die Circumnutationen nur schwach ausgeprägt. Gegen Ende des Versuchs klangen Wachstum und Schwingungen allmählich aus. Bei der realen Pflanze in Abb. 3-73 wurde über vier Tage fast das gesamte Hypokotyl von Schwingungen erfasst. Bei der Simulation in Abb. 3-75 waren Schwingungen gegen Ende des Versuchs nur noch im oberen "Hypokotylbereich" zu beobachten. Dies lag an der Wahl des Parameters LENACTLEN, der die Länge der Wachstumszone bestimmt. Es gab jedoch auch reale Pflanzen, bei denen das Hochwandern der Schwingungszone deutlicher sichtbar wurde. Horizontale farbige Banden, die von statischen, lokalen Krümmungen der Pflanzen herrührten oder aber Auswerteartefakte darstellten, verschwanden sowohl bei realen Pflanzen als auch in der Simulation nach horizontaler Filterung. Eine Periodenverlängerung der Circumnutationen gegen Ende des Versuchs, wie sie bei realen Pflanzen häufig zu beobachten war, wurde in das Modell nicht eingebaut. Durch zeitgesteuerte Verlängerung der Periodendauer der zyklischen Anregung EXCIT_PER wäre dies jedoch leicht zu realisieren gewesen. Die Zeitverlaufsbilder der Auswertung bei zeitgesteuertem Zellwachstum waren denen bei längengesteuertem Zellwachstum, jeweils mit tagesperiodischer Modulation, recht ähnlich.
Am Modell sollte geprüft werden, ob Circumnutationen außer durch zyklische Anregung auch durch lateralen, chiralen Auxintransport erzeugt werden können. Hierfür wurden die im Simulationsprogramm enthaltenen Funktionen für den lateralen Auxintransport (AUXIN_TO_LEFT und AUXIN_TO_RIGHT) verwendet, mit denen eine bestimmte Menge "Auxin" bei jedem Simulationsschritt von einer "Zelle" in die rechte oder linke oder in beide benachbarten "Zellen" weitergeleitet werden konnte. Um durch chiralen, lateralen Auxintransport überhaupt Wachstumsunterschiede und möglicherweise Schwingungen erreichen zu können, war eine asymmetrische "Auxineinspeisung" in die oberste "Zelllage" unabdingbar. Bei komplett symmetrischer "Auxinzufuhr" von oben bewirkt eine chirale, laterale "Auxinverschiebung" nichts, da jede "Zelle" von der einen "Nachbarzelle" stets genau soviel "Auxin" erhielt, wie sie an die andere "Nachbarzelle" weitergab. Die "Auxinkonzentration" blieb somit in allen "Zellen" einer "Zelllage" gleich und die Pflanze wuchs senkrecht, ohne zu schwingen. Bei asymmetrischer "Auxineinspeisung" in die oberste "Zelllage" hingegen bewirkte eine chirale, laterale, in allen "Zellen" stattfindende "Auxinverschiebung", dass die Maxima und Minima der "Auxinkonzentration" in weiter unten liegenden "Zelllagen" bezüglich der obersten "Zelllage" nach rechts oder nach links verschoben wurde. Dies betraf besonders den oberen "Hypokotylteil". In den unteren "Zelllagen", die ja zuerst elongieren, verteilte sich das "Auxin" immer mehr, so dass die "Pflanze" zunächst fast senkrecht wuchs. Erst gegen später, als das Wachstums die oberen "Zellen" erreichte, wurde der Effekt sichtbar. Das "Hypokotyl" nahm dann eine korkenzieherartige Form an. Um die Animation
zu starten klicken Sie bitte auf das Player-Symbol der gewünschten
Version
Auch im Zeitverlaufsbild (Abbildung 3-82) wurde deutlich, dass es zu keinen Schwingungen kam. Die korkenzieherartigen Krümmungen waren vielmehr in bezug auf die einzelnen Zelllagen ortskonstant. Im Laufe des Wachstums der unteren "Zellen" wanderten sie mit nach oben. |
|
© copyright Andreas Neugebauer 2002 Optimiert für Microsoft Internet Explorer und Netscape Version 6 |
||