|
1.4 Verwendete Phytohormone,
Phytotropine und andere physiologisch aktive Substanzen
1.4.1 Auxine
Indol-3-essigsäure (IES) ist die
am häufigsten natürlich vorkommende Substanz aus der Klasse
der Auxine. Daneben wurde 4-Chlorindol-3-essigsäure (4-Cl-IES),
IBA (Indolbuttersäure) und Phenylessigsäure (PES) in Pflanzen
gefunden. IES ist chemisch mit der Aminosäure Tryptophan verwandt.
Es wird angenommen, dass IES aus dieser synthetisiert wird. Syntheseorte
von IES sind meristematische Gewebe, junge Blätter und die
Sprossachsenspitze (Apex). Bei Dikotyledonen ist der Apex der wichtigste
Bildungsort für IES. Von ihm gehen IES-Pulse aus und erhöhen
in subapikalen Regionen das Streckungswachstum (YANG et al., 1993).
Die optimale Konzentration für die Elongation von Hypokotylen
liegt zwischen 1 und 10 mM. Bei Hypokotylabschnitten, die in einem
wässrigen Medium mit Auxin behandelt werden, beträgt die
Zeitverzögerung bis zum Einsetzen der Wirkung etwa 10 Minuten.
Die Auxinwirkung kann bis zu 20 Stunden anhalten. Werden Hypokotylabschnitte
oder Koleoptile in auxinfreie wässrige Lösungen mit niedrigem
pH eingebracht, steigt die Wachstumsrate. Dieser Wachstumsschub
hält jedoch nur für etwa eine Stunde an.
Stängelsegmente, die der Länge
nach halbiert wurden, biegen sich nach außen. Wird dem Medium
jedoch Auxin zugegeben, biegen sie sich nach innen. Dies zeigt,
dass Auxin das Wachstum von Zellen der Epidermis und des äußeren
Kortex fördert. Auch ein lateraler Transport von Auxin zwischen
Zellen ist möglich. Die physiologischen Grundlagen des auxinbedingten
Streckungswachstums basieren auf einer Lockerung der Zellwand (Säurewachstumshypothese)
und wurden von SCHUSTER (1996) zusammengefasst.
Auxin hemmt die Wurzelstreckung. Ursprünglich
wurde angenommen, dass Auxin die Synthese von Ethylen steigert und
dadurch das Wurzelwachstum gehemmt wird. Neuere Experimente in Gegenwart
von Ethyleninhibitoren zeigen jedoch, dass Auxin in Konzentrationen
von 0.1 bis 1 nM das Wurzelwachstum fördert, während Konzentrationen
von 1mM und darüber hemmend wirken (BRUSSLAN, 1999).
Auxin kann zusammen mit den Assimilaten
im Phloem oder polar im Parenchym transportiert werden. Auch der
Transport im Transpirationsstrom des Xylems wurde beobachtet. Der
polare Auxintransport ist in seiner Richtung unabhängig von
Gravitation und Massenfluss. Statt dessen spielt die Verteilung
von Carriern in der Plasmamembran eine wichtige Rolle (LOMAX et
al., 1995). Nach der chemiosmotischen Hypothese des polaren IES-Transports
(RUBERY und SHELDRAKE, 1974; RAVEN, 1975) wird die Zellwand durch
ATPasen in der Plasmamembran angesäuert (pH 5,5). In diesem
Milieu verschiebt sich das Gleichgewicht von dissoziierter IES-
in Richtung undissoziiertes IES-H. Da IES-H die Plasmamembran passieren
kann, dringt es auf Grund des Konzentrationsgefälles ins Cytoplasma
ein. Unter dem dort herrschenden pH-Wert von 7,0 dissoziiert IES-H
wieder zu IES- + H+. Dieses kann die Zelle nur noch über Carrier
verlassen. Da die Efflux-Carrier in den Zellen basal angeordnet
sind, geschieht der Transport polar und setzt sich über die
folgenden Zellen in derselben Art und Weise fort. Für die Regulation
des Auxintransports scheint der Efflux-Carrier von entscheidender
Bedeutung zu sein. Daneben wird jedoch auch ein Influx-Carrier beschrieben
(MUDAY, 2000).
Die Geschwindigkeit des basipetalen,
polaren Transports von Auxin in Sprossachsen liegt zwischen 5 und
25 mm/h. Dies ist verglichen mit der Transportgeschwindigkeit im
Phloem (30 - 150 cm/h) relativ langsam, aber immer noch 10 mal schneller
als die Geschwindigkeit, die man bei reiner Diffusion erwarten würde.
Neben basipetalem Transport wurde jedoch auch ein acropetaler Transport
(von der Basis zur Spitze) beobachtet. JACOBS (1961) fand bei Coleus
Stängelabschnitten ein Verhältnis von drei zu eins zwischen
basipetalem Transport und acropetalem Transport.
Der Phototropismus basiert auf asymmetrischer
Auxinverteilung. Licht wird vornehmlich von der Sprossspitze wahrgenommen
und bewirkt einen lateralen Auxintransport zur Schattenseite. Die
erhöhte Auxinkonzentration auf der dem Licht abgewandten Seite
steigert das Wachstum. Dadurch krümmt sich das Hypokotyl zur
Lichtquelle. Die frühere Annahme, dass Auxin auf der lichtzugewandten
Seite zerstört würde, hat sich als falsch herausgestellt
(BRUSSLAN, 1999).
Auch am Gravitropismus ist Auxin beteiligt.
Die gravitrope Reaktionszeit bei Arabidopsis
beträgt ca. 45 Minuten. Der Reaktion geht eine Umverteilung
von Auxin voraus. Viele auxinresistente Mutanten von Arabidopsis,
wie aux1, axr2, axr3, eir1 und dwf sind auch agravitropisch, was
ebenfalls darauf hinweist, dass Auxin eine wichtige Rolle beim Gravitropismus
spielt.
Ein Großteil des Auxins liegt in
Pflanzen in inaktiver, konjugierter Form vor. Kleinere Moleküle,
mit denen IES konjugiert, sind Glucose, myo-Inositol und Asparaginsäure.
Zu den größeren Konjugaten gehören Glucane and Glycoproteine.
Beispielsweise liegt IES als IES-myo-Inositol im Endosperm von Zea
mays vor. Als solches wird es durch das Phloem in die wachsende
Koleoptile verlagert. Erst hier wird das Konjugat hydrolysiert und
entfaltet seine Wirkung.
Der Abbau von IES erfolgt durch biochemische
Oxidation zu OxIES (Oxindol-3-essigsäure). Auch unter der Einwirkung
von Licht wird IES oxidiert. Die physiologische Bedeutung dieser
Photodestruktion ist jedoch unbekannt.
Synthetische Auxine wie 2,4 D (2,4-Dichlorphenoxyessigsäure),
1-NAA (1-Naphthylessigsäure), und IBA (Indolbuttersäure)
werden als Herbizide, Bewurzelungsmittel und für andere Zwecke
in der Landwirtschaft verwendet. Sie sind langlebiger als IES, was
neben ihrer höheren Stabilität auch daran liegt, dass
sie im Stoffwechsel nicht abgebaut werden.
1.4.2 Auxin-Transport-Inhibitoren
Die Auxin-Transport-Inhibitoren NPA (1-N-Naphthylphtalaminsäure)
und TIBA (2,3,5-Triiodobenzoesäure) hemmen den polaren Auxintransport.
Sie werden auch als Antiauxine oder Phytotropine bezeichnet. Beide
Substanzen hemmen den basalen Efflux von Auxin, während der
apikale Influx bestehen bleibt. Somit sammelt sich Auxin in den
Zellen, was die Auxinkonzentration in den behandelten Organteilen
erhöht. NPA bindet an den Auxin-Efflux-Carrier (DAVIES und
RUBERY, 1978; HERTEL et al.,
1983; MORRIS et al., 1991).
Es wird dort von spezifischen Aminopeptidasen auf der Plasmamembrane
hydrolysiert. Werden diese Aminopeptidasen gehemmt, reichert sich
Auxin in den Zellen an. Dies spricht dafür, dass sie den Auxintransport
mit regulieren (MURPHY und TAIZ, 1999). Interessanterweise beeinflusst
NPA das Wachstum von Arabidopsis-Hypokotylen,
die im Dunkeln gezogen werden, nicht. Die Wachstumshemmung durch
eine einheitliche Konzentration von NPA variiert von 0% Hemmung
in der Dunkelheit bis 75% Hemmung bei Weißlicht (Photonenfluss
50 µmol m-2 s-1) in dosisabhängiger Weise. Die gravitrope
Reaktion wird durch NPA jedoch auch im Dunkeln gestört (JENSEN
et al., 1998).
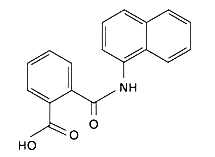
Abbildung 1-1
NPA
TIBA ist ein schwaches Auxin. Man nimmt an,
dass es mit IES um den Efflux-Carrier konkurriert. Anders als NPA,
welches nicht transportiert wird, unterliegt TIBA einem gewissen
basipetalen Transport.
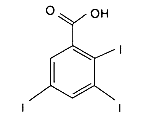
Abbildung 1-2
TIBA
1.4.3 Gibberelline
Gibberelline werden in den Spitzen von
Trieben und Wurzeln sowie in Embryos, Kotyledonen, Früchten
und Knollen synthetisiert. Sie wurden zuerst aus dem Pilz Gibberella
fugikuroi isoliert, der bei infizierten
Reispflanzen zu Riesenwuchs führt. Gibberelline kommen in verschiedenen
Formen in Geweben vor und nur einige von ihnen sind biologisch aktiv.
GA3 ist das am weitesten verbreitete Gibberellin.
Gibberelline besitzen unter anderem folgende
physiologischen Effekte:
· Zellstreckung: Manche Zwergmutanten erreichen bei Applikation
von Gibberellinen die normale Größe des Wildtyps
· Zellteilung: Gibberelline fördern zusammen mit IES
die Zellteilung
· Fruchtreife: Förderung von Fruchtansatz, Fruchtwachstum
und Fruchtreife
1.4.4
Cycloheximid
Das heterozyklische Antibiotikum Cycloheximid
blockiert reversibel die Proteinsynthese, indem es die Transkription
in zytosolisch lokalisierten Ribosomen von Eukaryonten hemmt. Dies
geschieht durch Blockieren der Peptidbindung nach Ankopplung einer
neuen Aminosäure an der tRNA (ALBERTS et
al., 1994).
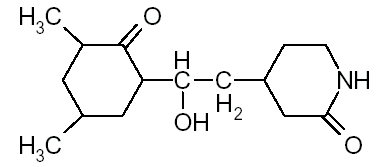
Abbildung 1-3
Cycloheximid
1.4.5 Jasmonsäure
Jasmonsäure und ihr Methylester
Methyljasmonat sind Pflanzenhormone, die unter anderem auch auf
die Zellstreckung wirken (SEMBDNER und PARTHIER, 1993). Sie scheinen
dabei die Struktur der Zellwand und die Orientierung kortikaler
Mikrotubuli zu beeinflussen (CREELMAN und MULLET, 1997). Über
Protonenpumpen wirken diese Hormone auch auf den pH (LESHEM et
al. 1994; RAGHAVENDRA und REDDY,
1987). Die circadiane Blütenblattbewegung von Kalanchoe
wird durch Methyljasmonat gedämpft und die Periodenlänge
der Schwingung verkürzt. Das Hormon scheint auf den circadianen
Oszillator zu wirken (ENGELMANN
et al., 1997). Wegen seiner Wirkung
auf Zellstreckung und auf die circadiane Uhr wurde Jasmonsäure
benutzt, um zu untersuchen, ob es auch Zellstreckung und Circumnutation
von Hypokotylen beeinflusst.
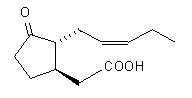
Abbildung 1.4 Jasmonsäure
1.4.6 Expansin
Circumnutationen des Hypokotyls treten
nur auf, wenn sich die Zellen strecken. Dazu muss die Primärwand
sich dehnen. Sie besteht aus einem polymeren Netzwerk kristalliner
Zellulose-Mikrofibrillen, die in einer hydrophoben Matrix von Hemizellulose
und Pektinen eingebettet sind. Das Strecken wird durch den Turgor
der Vakuole und durch besondere Vorgänge in der Zellwand ermöglicht,
bei denen die Zellulose-Mikrofibrillen neu verknüpft werden.
Dazu dienen Expansine, die bei niedrigem pH arbeiten (McQUEEN-MASON
et al.,
1992). Zu neueren Ergebnissen siehe den Übersichtsartikel von
COSGROVE (2000), aber auch den von KUTSCHERA (2001). Deshalb wurde
versucht, die Circumnutation des Hypokotyls von
Arabidopsis thaliana durch extern
appliziertes Expansin zu beeinflussen.
|