|
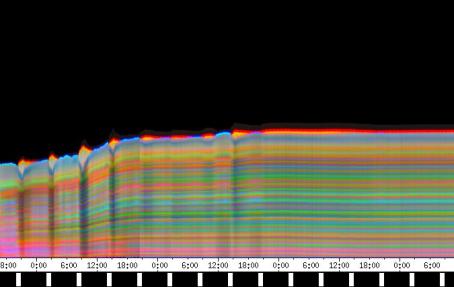
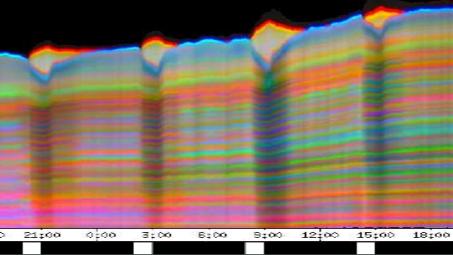
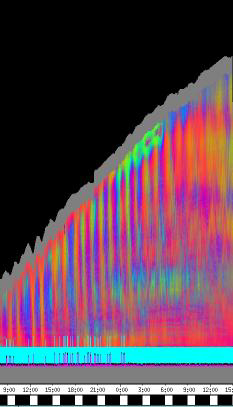
3.3 Ergebnisse der PC-Versuche Eine Reihe von Versuchen und Vorversuchen wurden mit dem von SCHUSTER (1990) entwickelten System OXALIS mit Atari PCs durchgeführt, bevor die neue Verfahreinheit fertiggestellt war. Wurden die Keimlinge von oben registriert, war es nicht nötig, Originalaufnahmen der Pflanzen zu machen. Auch einfachere Aufnahmen von der Seite unter Verwendung von Markierungen konnten mit diesem System durchgeführt werden. 3.3.1.1 Registrierung von oben mit Atari PCs 3.3.1.1.1 Wie ändern sich die Periodenlängen der Circumnutationen im Laufe des Wachstums der Keimlinge? Im Rahmen von Versuchen zur lokalen Applikation von Expansin wurde auch die Entwicklung der Periodenlängen der Circumnutation bei Cardaminopsis arenosa untersucht. Dabei zeigte sich eine einheitliche Tendenz zur Verlängerung der Schwingungsperioden mit zunehmendem Alter der Keimlinge. Die Circumnutationen traten häufig in tagesperiodischen Schüben auf. Hierbei wurden die mittleren Schwingungsperioden von Schub zu Schub länger. Bei stärkerer Beleuchtung war die mittlere Periodenlänge meist größer als im Schwachlicht. Die Pflanzen wuchsen wesentlich langsamer und Circumnutationen konnten über einen längeren Zeitraum beobachtet werden. Die tagesperiodischen Schübe waren wesentlich deutlicher ausgeprägt als im Schwachlicht. Häufig fanden sich bei diesen Lichtbedingungen Schwingungen mit Periodenlängen im Bereich von zwei bis drei Stunden. Sie wurden von SCHUSTER (1996) als LPN2 klassifiziert.
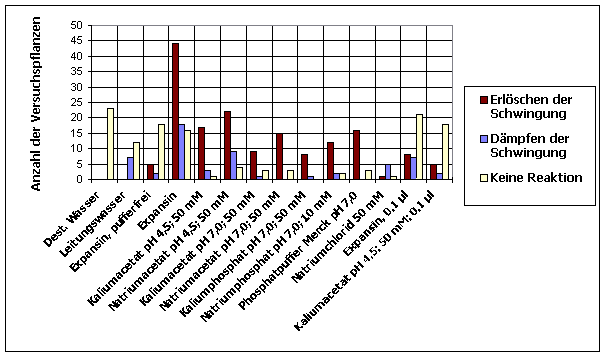
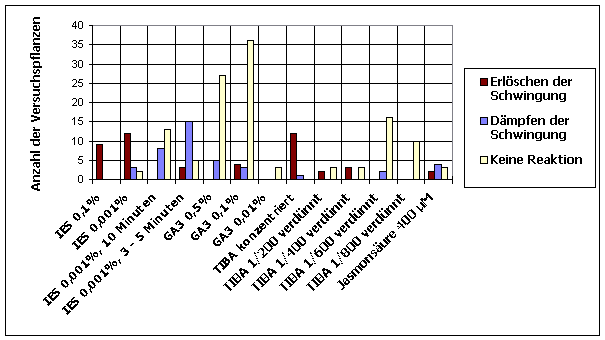
Tröpfchen wässriger Lösungen von Expansin und Referenzlösungen wurden wie in 2.2.1 beschrieben an den Hypokotylen von Cardaminopsis arenosa appliziert. Soweit in den Abbildungen nicht anders angegeben, war die applizierte Menge 1 µl. Die Keimlinge waren im schwachen weißen Dauerlicht[1] bei 23 °C angezogen und mit einem Atari PC von oben registriert worden. Die Reaktion wurde in drei Gruppen klassifiziert: Die Applikation von Expansin am Hypokotyl von schwingenden Keimlingen löschte in den meisten Fällen die Schwingungen überraschenderweise innerhalb weniger Minuten aus. Es ist bekannt, dass Expansin bei einem pH von 4,5 ein Optimum besitzt. Die verwendete wässrige Lösung von Expansin lag in einem 50 mM Natriumacetatpuffer mit pH 4,5 vor. Deshalb wurden Kontrollversuche mit reinem 50 mM Natriumacetatpuffer pH 4,5 durchgeführt. Die Applikation dieser Pufferlösung zeigte die gleiche Wirkung wie Expansin. Um zu prüfen, ob die Applikation von reinen Flüssigkeitströpfchen bereits die Circumnutationen beeinflusst, wurden destilliertes Wasser und Leitungswasser appliziert. Destilliertes Wasser bewirkte keine Reaktion. Leitungswasser führte in einigen Fällen zu einer Dämpfung. Meistens schwangen die Keimlinge jedoch auch nach Applikation von Leitungswasser weiter. Auch andere Pufferlösungen wurden appliziert, um die Wirkung verschiedener Ionen und pH-Werte auf die Circumnutation prüfen zu können. Alle applizierten Puffer- und Elektrolytlösungen zeigten eine deutlich hemmende oder dämpfende Wirkung. Eine pufferfreie Expansinlösung hingegen wirkte kaum. Die Wirkung hing von der Menge der applizierten Substanz ab. Wurden statt 1 µl nur 0,1 µl große Tröpfchen pufferhaltiger Expansinlösung oder Kaliumacetatpuffer pH 4,5 appliziert, wurde in den meisten Fällen die Circumnutation nicht gehemmt. Es wurde auch geprüft, ob nicht schwingende Keimlinge durch Applikation verschiedener Lösungen wieder zum Schwingen gebracht werden können. In wenigen Fällen kam es tatsächlich kurz nach der Applikation von Expansin, Elektrolytlösungen, Leitungswasser und destilliertem Wasser zu Schwingungen. Es war jedoch nicht zu entscheiden, ob ein ursächlicher Zusammenhang zwischen Auftreten von Schwingungen und Applikation bestand. Es könnte sich auch lediglich um ein spontanes Einsetzen von Schwingungen zeitnah zur Applikation gehandelt haben. 3.3.1.1.3 Haben an bestimmten Hypokotylstellen applizierte Lösungen von Auxinen, Gibberellinen, Auxintransporthemmern und Jasmonsäure eine Wirkung auf Circumnutationen? Tröpfchen wässriger Lösungen von Indolessigsäure, GA3, TIBA und Jasmonsäure[2] wurden wie in 3.3.1.1.4. an Hypokotylen von Cardaminopsis arenosa appliziert. Applikation von 0,1%iger wässriger Lösung von IES ließ in allen Fällen die Schwingungen sofort erlöschen. Auch eine 0,001%ige Lösung wirkte regelmäßig dämpfend oder hemmend. Wurden die Tröpfchen nach 3 bis 10 Minuten durch Abtupfen mit einem Filterpapierstreifen wieder entfernt, fiel die Wirkung schwächer aus. Ähnliche Ergebnisse wurden bei Applikation von IES-haltigem Lanolin auf Kunststoffkügelchen erzielt. GA3 zeigte bei Konzentrationen von 0,5% bis
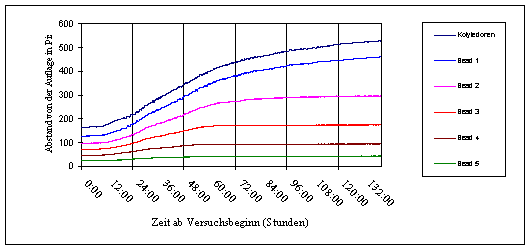
0,01% kaum eine Wirkung auf die Circumnutationen. 400 µM Jasmonsäurelösung unterdrückte oder hemmte in manchen Fällen die Schwingungen. 3.3.1.2 Registrierung von der Seite mit Atari PCs und Beads SCHUSTER (1996) hatte beschrieben, dass das Wachstum sowie das Auftretens von Circumnutationen beim Hypokotyl von Cardaminopsis arenosa circadian moduliert ist. Dabei betrachtete er jedoch nur den Längenzuwachs der ganzen Pflanze. Mit Hilfe von kleinen Kunststoff-Kügelchen (Beads), die in regelmäßigen Abständen auf dem Hypokotyl angebracht waren, sollte nun die Lage der Wachstumsschübe auf dem Hypokotyl lokalisiert werden.
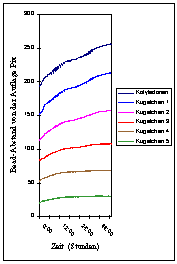
In Abbildung 3-9 wurde der Abstand vom Boden für jedes Kügelchen sowie für die Kotyledonen über die Zeit aufgetragen. Zu Beginn der Registrierung war bei allen Kügelchen eine deutliche Bewegung nach oben zu erkennen. Etwa 12 Stunden nach Versuchsbeginn hörte das Wachstum bei den beiden untersten Kügelchen nahezu vollständig auf. Auch bei den weiter oben liegenden flachte sich zu dieser Zeit die Wachstumskurve ab. Einige Stunden später nahm bei den oberen Kügelchen das Wachstum wieder zu. Bei den beiden untersten Kügelchen fand jedoch kein Wachstum mehr statt. Das Abflachen und Wiederansteigen der Wachstumsgeschwindigkeit im Zeitabstand von etwa 24 Stunden entsprach der bereits von SCHUSTER (1996) beschriebenen circadianen Modulation des Wachstums. Bei den Kotyledonen, (Kügelchen 1) und ansatzweise bei Kügelchen 2 waren außerdem in den Phasen stärkeren Wachstums kurzperiodische Circumnutationen mit einer Periodenlänge von etwa einer Stunde zu erkennen. Circumnutationen stellen bei der Aufnahme von der Seite eine Bewegung des Messpunkts in der x-Richtung und z-Richtung dar. Da die Pflanze an der Basis fest verankert ist, resultiert aus einer solchen Bewegung auch stets eine geringe Bewegung in der y-Richtung. Aus geometrischen Gründen ist die resultierende y-Komponente umso ausgeprägter, je weiter oben der Messpunkt liegt. Bei der in Abbildung 3-8 gewählten Form
der Darstellung entspricht der Kurvenverlauf der einzelnen Punkte
jeweils dem Wachstum des gesamten darunter liegenden Hypokotylbereichs.
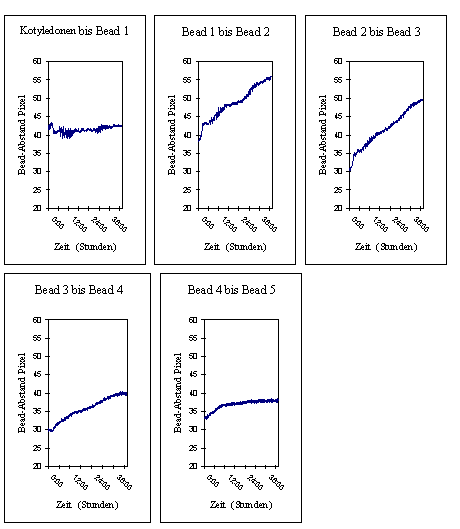
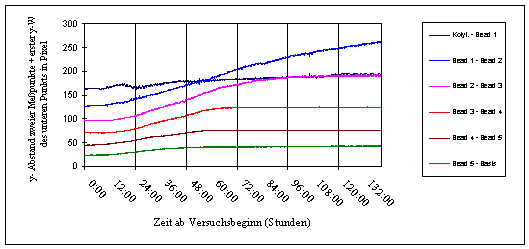
Um das lokale Wachstum darzustellen, wurde in der nachfolgenden
Abbildung jeweils der Abstand zwischen zwei Messpunkten im gleichen
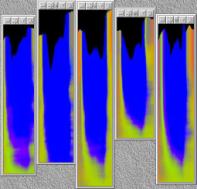
Versuch dargestellt. Der Abstand zwischen dem obersten Bead und den Kotyledonen änderte sich über die gesamte Aufnahmedauer nur sehr wenig. Das oberste Bead war nur wenige Millimeter unterhalb des Apex angebracht worden. Diese Region kurz unterhalb des Apex streckte sich im Versuchszeitraum also kaum. Das stärkste Wachstum fand zwischen Bead 1 und 2 und zwischen Bead 2 und 3 statt. Auch zwischen Bead 3 und 4 war fast über die gesamte Versuchsdauer ein deutliches Wachstum zu verzeichnen, das jedoch schwächer ausgeprägt war als bei den beiden darüber liegenden Hypokotylabschnitten. Etwa 12 Stunden und 36 Stunden nach Versuchsbeginn ging in allen drei Regionen die Wachstumsrate zurück. Zwischen Bead 3 und 4 fand Wachstum nur in der ersten Hälfte des Versuchs statt. Danach kam es zum Erliegen. Bei einem weiteren Versuch konnte das lokale Wachstum von Cardaminopsis arenosa über sechs Tage hinweg verfolgt werden. Diese Pflanze wurde unter identischen Bedingungen gehalten. Trotzdem war das circadiane Wachstums nur wenig moduliert. Auch Circumnutationen fanden so gut wie keine statt. Um das lokale Wachstum darzustellen, wurden bei diesem Versuch die Abstände zwischen je zwei Messpunkten in einem einzigen Diagramm dargestellt. Für eine bessere Übersicht wurden die einzelnen Datenreihen jeweils um einen festen Betrag nach oben verschoben. Die Verschiebung entsprach dem y-Wert des unteren Punktes des jeweiligen Punktepaares zu Versuchsbeginn. Die unterste Datenreihe wurde nicht verschoben, da dem unteren Referenzpunkt (der Hypokotylbasis) der y-Wert Null zugeordnet war. In den ersten 12 Stunden wuchs die Pflanze kaum. Danach war zwischen den meisten Messpunkten ein deutliches Wachstum zu erkennen. Nur die Region zwischen oberstem Kügelchen und den Kotyledonen vergrößerte sich auch bei dieser Pflanze über den gesamten Beobachtungszeitraum hinweg fast nicht. Das leichte Ansteigen und Absinken des Abstands beruhte auf einer Bewegung der Kotyledonen. Tagesperiodische oder circadiane Kotyledonenbewegungen waren bei Cardaminopsis und Arabidopsis häufig zu beobachten. Je nach Höhe der Messintervalle auf dem Hypokotyl hielt das Wachstum unterschiedlich lange an. Im untersten Intervall zwischen Bead 5 und der Hypokotylbasis war bereits nach 48 Stunden kaum noch Wachstum zu verzeichnen. In den darüber liegenden Abschnitten hielt es länger an, und zwar mit steigender Höhe am Hypokotyl für immer längere Zeit. Im Intervall zwischen Bead 1 und Bead 2 war selbst nach sechs Tagen noch ein deutliches Wachstum zu erkennen. Insgesamt wurden etwa zwanzig Hypokotyle mit Beads markiert und registriert. Der Versuchsaufbau und die Durchführung erwiesen sich als sehr mühsam und problematisch. In einigen Fällen fielen Beads während der Registrierung ab oder verrutschten. Außerdem veränderten sich beim Wachstum häufig die Beleuchtungsverhältnisse der Beads. Dadurch verrutschen die Trackingfelder. Da gleichzeitig eine Anlage entwickelt wurde, mit der "natürliche Markierungen" registriert werden konnten, wurden die Versuche mit dem OXALIS-System schließlich eingestellt. 3.3.2 Registrierung mit der eindimensionalen Verfahreinheit Die Registrierung von Keimlingen mit der eindimensionalen Verfahreinheit lieferte trotz eher geringer Qualität der Kameras dank Mittelung vieler Einzelbilder gute Ergebnisse. Mit Hilfe des Videoplayers konnte die Entwicklung vom Samen zum Keimling beobachtet werden. Dunkler und heller gefärbte Bereiche des Hypokotyls, die als "natürliche Markierungen" dienen können, waren deutlich zu erkennen. Wachstum und Circumnutationen konnten genau beobachtet werden. Um die Animation
zu starten klicken Sie bitte auf das Player-Symbol der gewünschten
Version
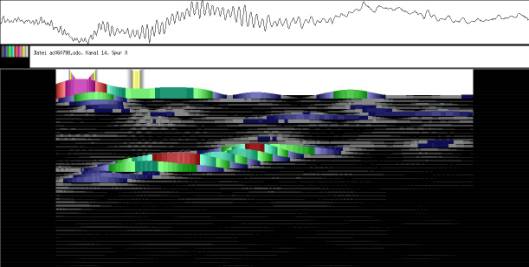
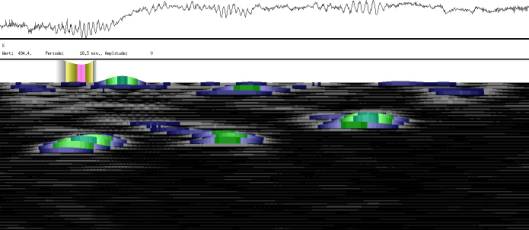
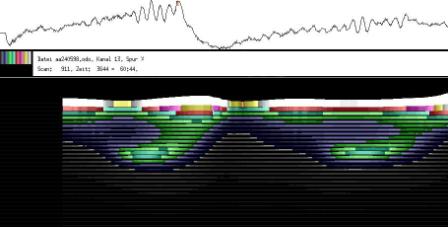
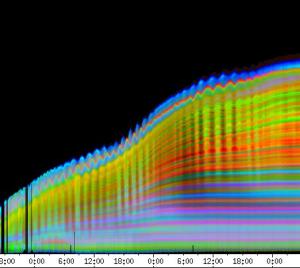
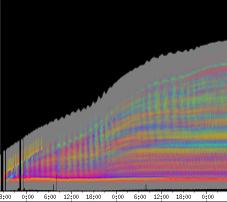
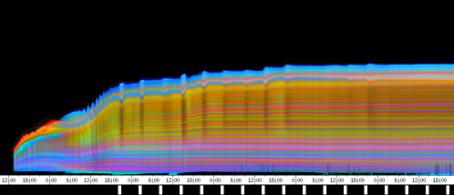
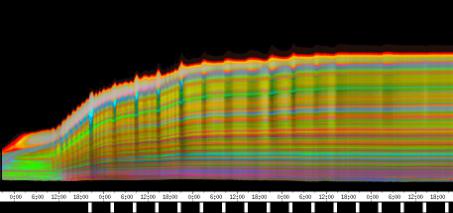
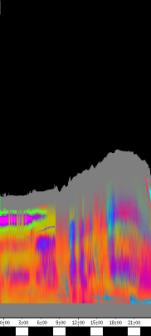
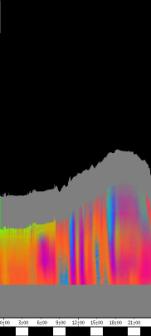
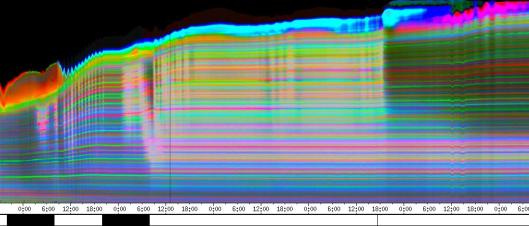
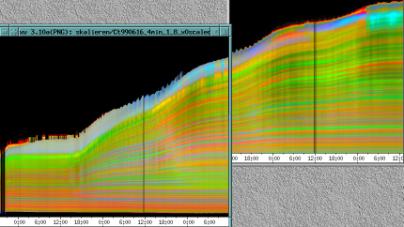
Im Zeitverlaufsbild des Wachstums waren die "natürlichen Markierungen" als farbige Streifen gut zu verfolgen. Durch sie konnten Bereiche des Hypokotyls, in denen Wachstum stattfand, von nicht wachsenden Bereichen unterschieden werden. Der untere Bereich des Zeitverlaufsbilds ist von blauen und violetten Linien geprägt. Wo diese Linien völlig parallel zueinander und horizontal verlaufen, findet kein Wachstum statt. Regionen in denen Wachstum stattfindet, sind dadurch gekennzeichnet, dass die Linien auseinanderstreben. In den Zeitverlaufsbildern des Wachstums war die circadiane Modulation der Wachstumsgeschwindigkeit gut zu erkennen. Die mit den Krümmungsalgorithmen ausgewerteten Zeitverlaufsbilder (Abbildung 3-15) ähnelten den Zeitverlaufsbildern des in "Material und Methoden" beschriebenen, auf einen Wecker montierten Drahts.
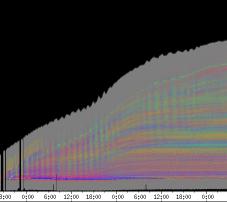
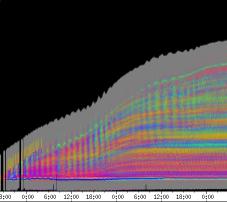
Abbildung 3-15: Zeitverlaufsbilder von Arabidopsis thaliana, Mutante pin, mit den verschiedenen Krümmungsalgorithmen ausgewertet. Versuch Pin990918_8 In den mit Algorithmus 4 bis 6 ausgewerteten Bildern war ebenfalls noch recht viel Rauschen enthalten. Die höheren Algorithmen, die eine Mittlung über größere Stängelbereiche beinhalteten, lieferten brauchbare Ergebnisse. Anders als der gebogene Draht besaßen die Keimlinge keine starken lokalen Krümmungen oder Knicke. Somit ließen sich bei der Auswertung von Hypokotylen auch Algorithmus 8 und 9 sinnvoll einsetzten. Der Verschiebungsalgorithmus lieferte ebenfalls
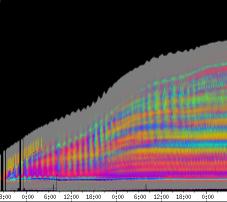
gute Ergebnisse (Abbildung 3-16). Er war besonders geeignet, den
Zeitverlauf von Circumnutationen und Reaktionen auf Reize, beispielsweise
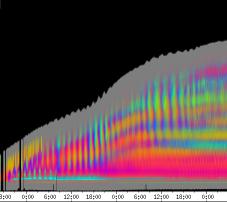
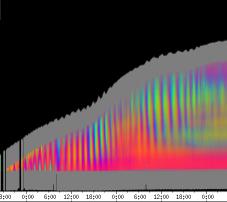
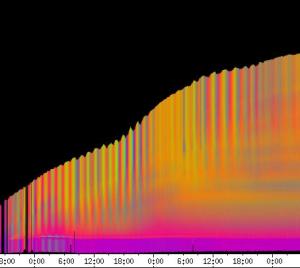
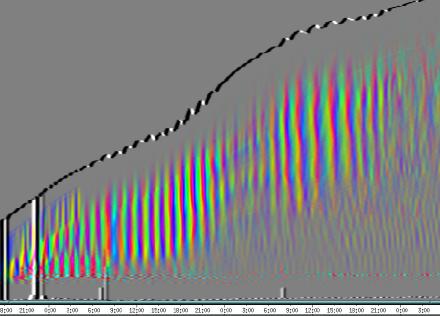
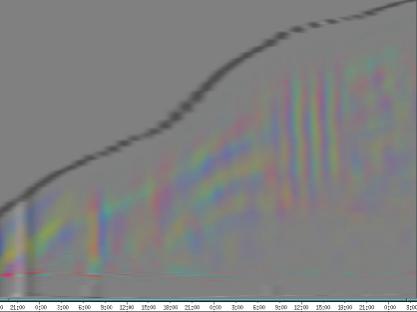
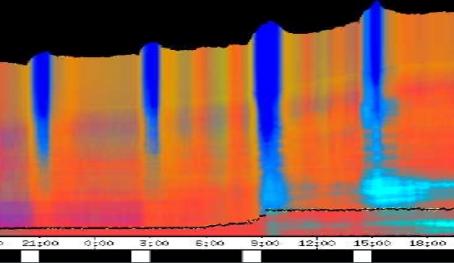
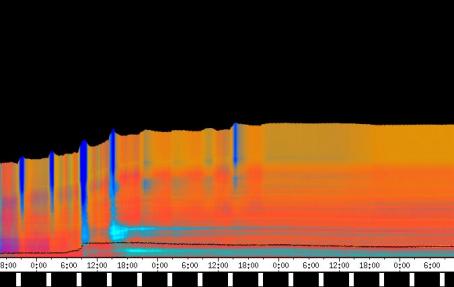
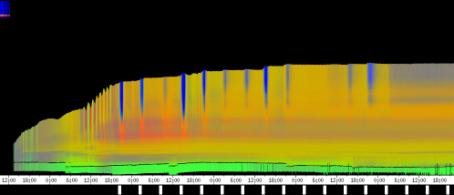
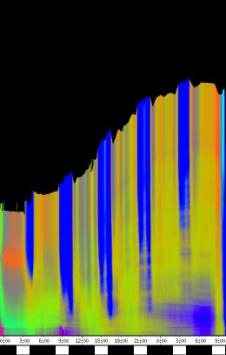
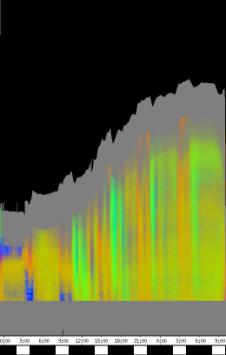
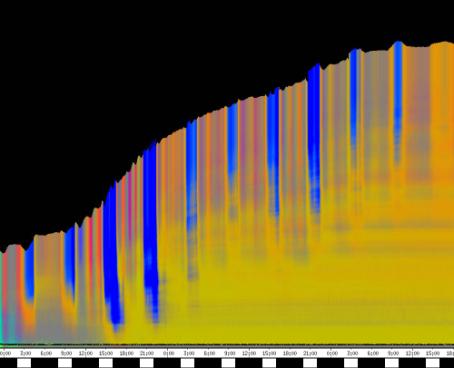
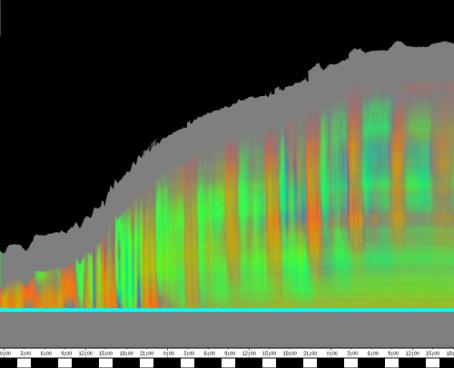
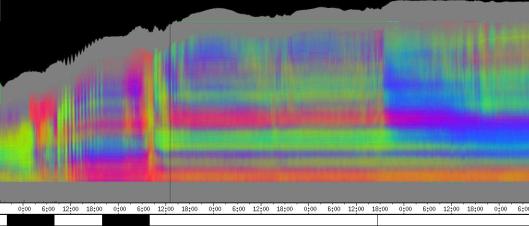
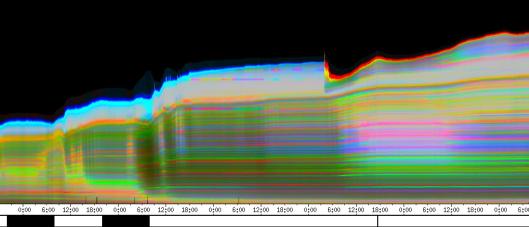
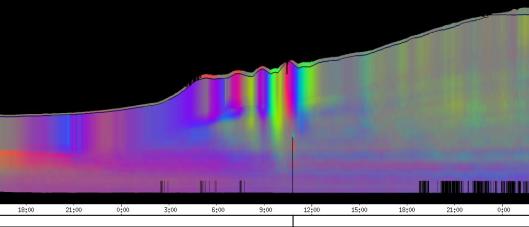
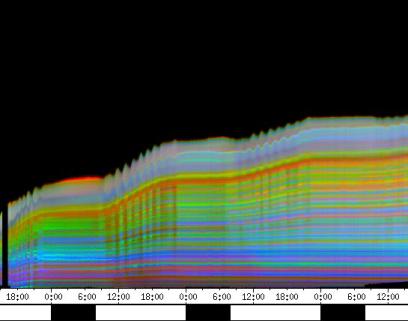
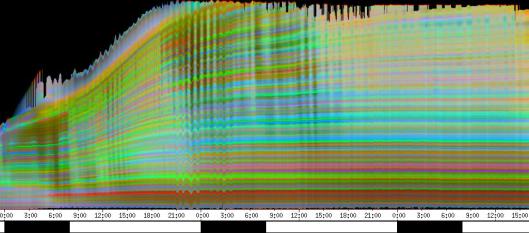
seitliche Lichtpulse oder Applikation von Substanzen, zu verfolgen. Solches Filtern bewirkte, dass langperiodische Bildanteile, beispielsweise ortskonstante Krümmungen der Pflanzen, die sich in den Originalbildern als horizontale, gefärbte Bänder zeigten, in den Hintergrund traten. Wurde ein Tiefpass mit niedrigerer Grenzfrequenz gewählt, beispielsweise 1/ 4h, konnten auch höherfrequente Bildanteile unterdrückt werden (Abbildung 3-18). In Abbildung 3-17 sind in den ersten zwei Versuchstagen ausgeprägte Circumnutationen mit einer Periodenlänge von durchschnittlich etwa 80 Minuten zu erkennen. In Abbildung 3-18, wo die Grenzfrequenz des Tiefpasses bei 1 / 4h lag, erscheinen diese Schwingungen nicht mehr. Dafür treten niederfrequentere Ereignisse zu Tage, beispielsweise die Schwingung zischen 6:00 und 9:00 Uhr am zweiten Versuchstag. 3.3.2.1 Circadiane Modulation der phototropen Reaktion Das Wachstum der Hypokotyle von Cardaminopsis arenosa erfolgt in mehr oder weniger deutlichen tagesperiodischen Schüben. Während dieser Schübe treten häufig Circumnutationen auf. Die Schwingungsphasen wiederholen sich in einem circadianen Rhythmus. Ob die Stärke der phototropen Reaktion der Hypokotyle von Arabidopsis thaliana und Cardaminopsis arenosa ebenfalls einem tagesperiodischen Rhythmus unterliegt, war bislang nicht untersucht worden. Deshalb wurden Keimlinge von Arabidopsis thaliana und Cardaminopsis arenosa mit der eindimensionalen Verfahreinheit von der Seite im schwachen Dauerlicht aufgenommen. In regelmäßigen Zeitabständen wurden die Keimlinge seitlich mit Blaulichtpulsen belichtet. Die Keimlinge waren im Licht-Dunkel-Wechsel angezogen worden, um die Phasenlage des circadianen Wachstums zu synchronisieren. In Abbildung 3-19 ist der Zeitverlauf des Wachstums von Arabidopsis thaliana, C24 dargestellt. Die Registrierung fand im schwachen Dauer-Weißlicht (1,2 µmol m-2 s-1) statt. Die Versuchstemperatur war 23 °C. Seitliche Blaulichtpulse[3] (0,6 µmol m-2 s-1, Dauer 1 h) wurden alle 6 Stunden gegeben. Die Keimlinge waren im LD (Lichtperiode von 08:00-20:00 Uhr) angezogen worden. Das Streckungswachstum war circadian moduliert. Nach einem mittelstarken Wachstum am Anfang stieg die Wachstumsgeschwindigkeit zwischen 9:00 und 15:00 Uhr des zweiten Tages deutlich, um gegen 21:00 wieder stark abzusinken. Zwischen 21:00 und 15:00 Uhr des dritten Tages war die Wachstumsrate sehr gering. Ein zweiter schwacher Wachstumsschub fand zwischen 15:00 und 18:00 Uhr des dritten Tages statt. Sobald die Pflanzen sich zu krümmen begannen, änderten sich die Beleuchtungsverhältnisse, was sich in einer dunkleren Farbe des Zeitverlaufsbildes äußerte. Die phototrope Reaktion setzte mit einer Zeitverzögerung ein (siehe die vergrößerte Darstellung in Abbildung 3-20). Deutlicher als bei den Zeitverlaufsbildern des Wachstums war die phototrope Reaktion bei den Zeitverlaufsbildern der Verschiebung (Algorithmus 2) zu erkennen. Die kräftig blau gefärbten Zonen in Abbildung 3-21 entsprechen einer Neigung des Hypokotyls zur blauen Lichtquelle. Die phototrope Reaktionszeit, d.h. die Zeit von Blaulicht-Beginn bis zum Beginn der phototropen Reaktion, beträgt etwa 24 Minuten. Die Stärke der phototropen Reaktion korreliert mit der Wachstumsgeschwindigkeit des Hypokotyls (Abbildung 3-22). Die deutlichsten Krümmungen wurden durch die Lichtpulse um 9:00 und 15:00 Uhr am zweiten Tag hervorgerufen. Eine weitere deutliche Krümmungsreaktion wurde nach dem Puls um 15:00 Uhr des dritten Tages registriert. In der Zeit zwischen 21:00 Uhr des zweiten Tages und 15:00 Uhr des dritten Tages mit geringem Wachstum war auch die gravitrope Reaktion nur schwach ausgeprägt. Nach 20:00 Uhr des dritten Tages konnte kein Wachstum mehr beobachtet werden. Eine gravitrope Reaktion war nach diesem Zeitpunkt ebenfalls nicht mehr zu beobachten. Weitere Versuche lieferten vergleichbare Ergebnisse. Die Abbildungen 3-23 bis 3-25 zeigen die Zeitverlaufsbilder von Versuchen mit Arabidopsis thaliana, C24 bei Auswertung mit dem Wachstums- und Verschiebungsalgorithmus. Die Versuchsbedingungen waren identisch mit denen in Abbildung 3-19. Blaulichtpulse erfolgten hier jedoch erst vom Abend des zweiten Versuchstages an. Im Zeitverlaufsbilds des Wachstums konnten 5 Wachstumsschübe beobachtet werden: 1. Tag - Versuchsbeginn bis 00:00 Der Längenzuwachs des Hypokotyls während der Wachstumsschübe wurde von Schub zu Schub geringer. Der letzte Schub war nur noch andeutungsweise zu erkennen. Auch die Länge der Schübe nahm nach und nach ab. Bei diesem Versuch waren anfangs noch keine seitlichen Lichtpulse gegeben worden. Die ersten beiden Pulse erfolgten gegen Ende des zweiten Wachstumsschubs. Die Reaktion auf diese Pulse war mittelstark. In der Zeit zwischen dem zweiten und dritten Wachstumsschub reagierte die Pflanze nur schwach auf das seitliche Störlicht. Das gleiche galt für die Zeiten geringen Wachstums zwischen dem dritten und vierten sowie dem vierten und fünften Wachstumsschub. Eine stärkere Reaktion war jeweils um 18:00 und 21:00 Uhr am dritten, vierten und fünften Tag zu beobachten. Danach fanden weder Wachstum noch Krümmungsreaktionen statt. Die Periodenlänge der circadianen Rhythmik lässt sich bei Wachstumsversuchen mit Arabidopsis thaliana nur ungefähr bestimmen. Beginn und Ende der Wachstumsschübe sind nur schwer festzulegen. Außerdem variiert die Dauer der einzelnen Schübe. Es treten zudem nur vier bis fünf deutliche Schübe auf. Bei dem in den Abbildungen 3-23 und 3-24 dargestellten Versuch (At990904_9) waren die stärksten Reaktionen auf die seitlichen Störlichter stets um 15:00 und 21:00 Uhr aufgetreten, was auf eine Periodenlänge von etwa 24 Stunden schließen lässt. Beim Versuch At990904_a in Abbildung 3-25 traten die stärksten Reaktionen am dritten Tag um 15:00 und 21:00 Uhr und am vierten Tag um 21:00 und 03:00 Uhr auf, wobei die erste Reaktion am vierten Tag stärker ausfiel als die zweite. Am fünften Tag war um 21:00 Uhr überhaupt keine Krümmung zu verzeichnen. Erst bei dem Puls um 03:00 Uhr erfolgte wieder eine schwache Reaktion. Diese Beobachtungen lassen vermuten, dass die hier gemessene Pflanze eine circadiane Periodenlänge der phototropen Reaktion von deutlich über 24 Stunden besaß.
Zur Fragestellung, ob es sich bei der phototropen Reaktion um elastische Vorgänge oder um Streckungswachstum oder um eine Kombination aus beidem handelt, lieferten die oben abgebildeten Zeitverlaufsbilder unterschiedliche Hinweise. Die ersten beiden Blaulichtpulse in Abbildung 3-23 (Versuch At990904_9) führten zu einem deutlichen Längenzuwachs des Hypokotyls im Verlauf des Pulses. Man erkennt einen vertikalen Versatz der farbigen Linienscharen im oberen Hypokotylbereich vor und nach dem Puls. Bei den späteren Pulsen war dieser Versatz jedoch wesentlich schwächer ausgeprägt. In Abbildung 3-26 (Versuch At990904_8) war trotz kräftiger Reaktionen auf die seitlichen Lichtpulse nur beim dritten Puls ein Linienversatz zu beobachten. Bei allen anderen Pulsen fand keine stärkere Verlängerung statt als die, die anhand des Kurvenverlaufs ohnehin zu erwarten gewesen wäre. In Abbildung 3-27 (Versuch At990904_a) hatten manche Pulse eine verlängernde Wirkung auf das Hypokotyl, andere jedoch nicht. Eine genauere Analyse von durch phototrope Reaktionen und Circumnutationen verursachten Krümmungen und den daraus resultierenden Längenänderungen des Hypokotyls steht noch aus. 3.3.2.3. Einfluss seitlicher Lichtpulse auf die Circumnutation Die Frage, ob es sich bei Circumnutationen um endogene Vorgänge oder um Regelvorgänge wie bei der gravitropen Rückkopplung handelt, ist noch nicht endgültig geklärt. Vieles spricht jedoch dafür, dass die Schwingungen endogener Natur sind (SCHUSTER 1996). Die Reaktion circumnutierender Keimlinge auf laterale Lichtpulse könnte hier weitere Hinweise liefern. Das gravitrope Feedback-Modell beschreibt, wie die Hypokotyle ihre gravitrope Orientierung durch einen Regelkreis aufrecht erhalten. Gerät das Hypokotyl aus der Senkrechten, setzt nach einer Latenzzeit eine Wachstumsreaktion ein, die die Abweichung korrigiert. Dies kann zu Schwingungen führen. Durch seitliches Störlicht krümmt sich der Keimling zur Lichtquelle. Wird einem circumnutierenden Keimling ein seitlicher Lichtpuls gegeben, würde man im Falle von gravitropem Feedback erwarten, dass die Circumnutation durch den Puls deutlich gestört wird. Sind die Schwingungen jedoch endogener Natur, würden sie auch während der Krümmungsreaktion mehr oder weniger unverändert ablaufen. Abbildung 3-28 bis 3-31 zeigen Zeitverlaufsbilder von Arabidopsis thaliana, C24. Die Registrierung fand im schwachen Dauer-Weißlicht (1 µmol m-2 s-1) statt. Seitliche Blaulichtpulse (0,6 µmol m-2 s-1, Dauer 2 h) wurden alle sechs Stunden gegeben. Die Versuchstemperatur war 23 °C. Die Pflanze befand sich in einem Zustand kräftigen Wachstums. Dabei fanden Circumnutationen mit einer durchschnittlichen Periodenlänge von 67 Minuten statt. Die Schwingungen hielten während der phototropen Reaktionen an. Weder Phasenlage noch Periodenlänge der Circumnutationen wurden durch die phototrope Reaktion massiv gestört. Auch bei dieser Pflanze sowie bei der in Abbildung 3-30 gezeigten hielten die Schwingungen während der Pulse an. Im folgenden animierten Bild kann das Wachstum dieser Pflanze anhand einer Originalaufnahme verfolgt werden. (nur in der Online-Version verfügbar) Um die Animation
zu starten klicken Sie bitte auf das Player-Symbol der gewünschten
Version
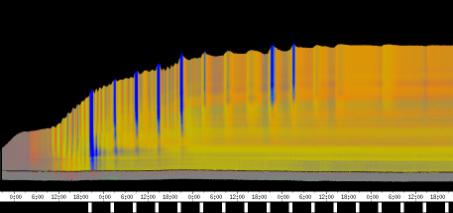
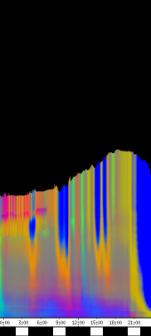
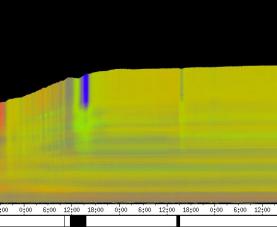
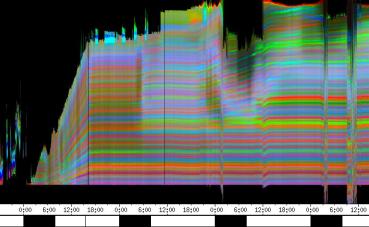
Die phototropen Krümmungen finden prinzipiell in der gleichen Region des Hypokotyls statt wie die Circumnutationen. Die folgenden Abbildungen zeigen Zeitverlaufsbilder von Cardaminopsis arenosa. Bei diesem Versuch wurden seitliche Lichtpulse in kürzerem Zeitabstand (alle 3 Stunden) und von geringerer Intensität (0,3 µmol m-2 s-1, Dauer 30 min.) als in den vorhergehenden Versuchen gegeben. Die Registrierung fand im schwachen Dauer-Weißlicht (1 µmol m-2 s-1) statt. Die Versuchstemperatur war 23 °C. Die Keimlinge waren im Dauerlicht angezogen worden. Der rasch wachsende Keimling zeigt deutliche Circumnutationen mit einer Periodenlänge von etwa 90 Minuten. Eine phototrope Reaktion auf die schwachen seitlichen Blaulichtpulse ist in dieser Darstellung nicht zu erkennen. Die nächste Abbildung zeigt das gleiche Zeitverlaufsbild, das horizontal mit einer Grenzfrequenz von 1 / 3h gefiltert wurde. Dadurch wurden alle Frequenzanteile mit einer Periodenlänge unter 3 h abgesenkt. Im gefilterten Bild werden nun die Reaktionen auf die seitlichen Blaulichtpulse deutlich sichtbar. 3.3.2.4.1 Versuche zur Applikation von Indol-3-essigsäure Indol-3-essigsäure (IES) spielt eine zentrale Rolle bei Wachstumsvorgängen, phototropen und gravitropen Reaktionen und vermutlich auch bei Circumnutationen. Mit der eindimensionalen Verfahreinheit wurde deshalb die Wirkung von lokal am Hypokotyl applizierter IES untersucht. Tröpfchen einer 5 µM IES-Lösung mit einem Volumen von 1 bis 2 µl wurden am obere Hypokotyl oder den Kotyledonen von wachsenden Hypokotylen angebracht. Dies führte nach einer Latenzzeit stets zu einem Wachstumsschub. Vor der Applikation waren regelmäßige Circumnutationen mit einer Periodenlänge von etwa einer Stunde zu beobachten. Nach der Applikation von 5 µM IES-Lösung kamen diese Schwingungen zum Erliegen. Auch bei allen anderen Applikationsversuchen mit 5 µM IES-Lösung wurden langperiodische Schwingungen ausgelöscht. Etwa 20 Minuten nach der Applikation begann dann ein Wachstumsschub, der hier etwa eine Stunde anhielt. Bei dem in Abbildung 3-35 dargestellten Versuch war 20 Minuten nach der ersten Applikation ein zweiter Tropfen angebracht worden. Die zweite Applikation steigerte die Wachstumsgeschwindigkeit jedoch nicht weiter. Neben Wachstumsschüben führte die Applikation von IES-Lösung meist auch dazu, dass sich das Hypokotyl von der Applikationsseite weg krümmte.
Bei dem Versuch in Abbildung 3-36 ist 20 Minuten nach der Applikation der Beginn eines Wachstumsschubs zu erkennen. Danach beginnt eine Krümmungsreaktion, die sich im Zeitverlaufsbild aufgrund veränderter Beleuchtungsverhältnisse in einer dunkleren Färbung äußert. In der folgenden Zeitrafferaufnahme können Applikation und Krümmungsreaktion verfolgt werden. Um die Animation
zu starten klicken Sie bitte auf das Player-Symbol der gewünschten
Version
Die Krümmung beginnt in der Umgebung der Applikationsstelle. Im Laufe der Zeit erfasst sie immer weiter unten liegende Bereiche des Hypokotyls. Das Herabwandern der Krümmungszone wird auch im Zeitverlaufsbild der Krümmung deutlich. In Abbildung 3-38 tritt etwa 90 Minuten nach der Applikation im oberen Bildbereich eine intensive Blaufärbung auf. Im Laufe der Zeit werden weiter unten liegende Bildteile von der Blaufärbung erfasst. In den oberen Bildtteilen treten dann wieder rote und grüne Banden auf, die von Circumnutationen herrühren. Die Pflanze zeigte im gekrümmten Zustand deutliche Schwingungen. Am Ende des Zeitverlaufsbildes beschränkt sich die blaue Zone auf ein Band im unteren Drittel: Die Pflanze wies hier einen kräftigen Knick auf, während die darunter und darüber liegenden Hypokotylteile fast gerade verliefen. Mit Hilfe der Zeitverlaufsbilder des Wachstums konnte die Reaktionszeit nach Auxinapplikation bestimmt werden. Dazu wurden Bildausschnitte um den Applikationszeitpunkt horizontal stark vergrößert. Dadurch traten einzelne "scans" deutlich als vertikale Balken in Erscheinung. Um die Reaktionszeit nach Auxinapplikation genau zu bestimmen, wurden "scans" im Ein-Minuten-Abstand durchgeführt. Die Reaktionszeit betrug 18,9 Minuten. (Schwaches Dauer-Weißlicht (1,75 µmol m-2 s-1), Applikation von 1 µl einer 5µM IES-Lösung. Durchschnitt aus 7 Pflanzen). Die Applikation einer 0,5 µM IES-Lösung führte in den meisten Fällen zu einer Wachstumssteigerung. Auf eine 0,05 µM IES-Lösung reagierten nur noch manche der Keimlinge mit einem Wachstumsschub. Auch bei den niedrigeren Auxinkonzentrationen dauerte es durchschnittlich 20 Minuten, bis die Pflanzen auf die Applikation reagierten. Bei stärkerer Beleuchtung (15 µmol m-2 s-1) änderte sich die Reaktionszeit ebenfalls nicht. Bei Applikation einer 0,05 µM IES-Lösung kam es vor, dass lediglich eine Krümmungsreaktion und kein Wachstumsschub auftrat. Anders als bei der höher konzentrierten Lösung war die Krümmung jedoch von vorübergehender Natur und es entwickelte sich kein Knick im unteren Hypokotylbereich. Die IES-induzierte Krümmung wurde gelegentlich von Circumnutationen überlagert. In der folgenden Zeitrafferaufnahme können Applikation einer 0,05 µM IES-Lösung und Krümmungsreaktion verfolgt werden. Zugehörige Zeitverlaufsbilder und Beschreibung siehe Abbildung 3-41. Um die Animation
zu starten klicken Sie bitte auf das Player-Symbol der gewünschten
Version
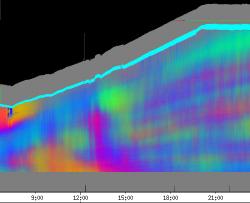  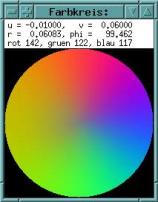 Abbildung 3-41Links: Cardaminopsis arenosa. Zeitverlaufsbild, Krümmungsalgorithmus 9. Applikation von 1 µl 0,05 µM IES-Lösung um 12:16 Uhr. Nach der Reaktionszeit beginnt die Krümmung, erkennbar an der violetten Färbung. Man sieht am schrägen Verlauf der violetten Färbung, dass die Krümmungszone den Stängel hinabwandert. Mitte: Ausschnitt, horizontal gefiltert mit einer Grenzfrequenz von 1/1h. Herablaufen der Krümmung (kräftig grüne Färbung; durch das horizontale Filtern und Differenzieren kehrt sich die Farbe der Darstellung um) in zwei Schüben. Schon vor der Applikation traten schwache Circumnutationen auf, die die Krümmungsreaktion anscheinend überlagern. Nach der Krümmung in Richtung "Grün" erfolgt eine Krümmung in Gegenrichtung (rot), die ebenfalls im oberen Teil des Hypokotyls einsetzt und sich nach unten ausbreitet. Rechts: Farbkreis zur Orientierung. Versuch Ct990428_1min_5 Während auxininduzierter Wachstumsschübe traten gelegentlich sehr schwache Schwingungen mit einer Periodenlänge von 10 bis 20 Minuten auf. Wegen der sehr kleinen Amplitude sind diese Schwingungen in den Zeitverlaufsbildern kaum zu erkennen. Um die Animation
zu starten klicken Sie bitte auf das Player-Symbol der gewünschten
Version
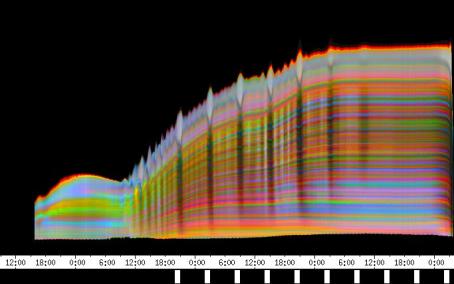
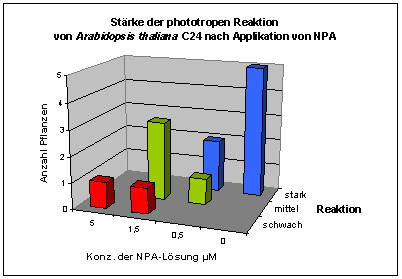
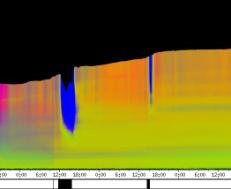
Mit der eindimensionalen Verfahreinheit wurden die Wirkungen von lokal am Hypokotyl appliziertem NPA bei Arabidopsis thaliana und Cardaminopsis arenosa untersucht. Tröpfchen von NPA-Lösung wurden am oberen Hypokotyl oder den Kotyledonen von wachsenden Hypokotylen angebracht. Die Pflanzen wurden dabei von der Seite registriert. Applikation von 1 µl 5 µM NPA-Lösung hemmte im mittleren Weißlicht (Photonenstrom 15 µmol m-2 s-1) das Wachstum von Cardaminopsis arenosa nur leicht (4 Pflanzen wurden registriert). Bei schwächerer Beleuchtung (1,75 µmol m-2 s-1) wurde das Wachstum von Cardaminopsis arenosa durch 1-2 µl 5 µM und 50 µM NPA nicht gehemmt (4 Pflanzen). Bei Arabidopsis thaliana wurde das Wachstum im Schwachlicht (1,75 µmol m-2 s-1) durch Applikation von 1-2 µl 1,5 und 5 µM NPA-Lösung bei etwa 40% der Pflanzen deutlich gehemmt. Die restlichen Pflanzen wuchsen unbeeinflusst weiter. Der in Abbildung 3-44 dargestellte Versuch zeigt, dass die Circumnutationen oberhalb der Applikationsstelle weiter gehen. In anderen Versuchen wurden die Circumnutationen durch Applikation von NPA in der Mitte des Hypokotyls jedoch vollständig unterbunden. Leider konnten nur wenige Versuche durchgeführt werden. Um die Wirkung von NPA auf die phototrope Reaktion von Arabidopsis thaliana zu untersuchen, wurden je 2 µl NPA-Lösung verschiedener Konzentration sowie destilliertes Wasser als Kontrolle am oberen Hypokotyl und an den Kotyledonen appliziert. Die Registrierung fand im schwachen Dauer-Weißlicht (1,75 µmol m-2 s-1) statt. Zwei seitliche Blaulichtpulse (0,6 µmol m-2 s-1) wurden gegeben. Das Weißlicht war während der Blaulichtpulse ausgeschaltet. Die phototrope Reaktion der mit NPA vorbehandelten Pflanzen war in konzentrationsabhängiger Weise schwächer als die der unbehandelten Kontrollgruppe. Bei der Auswertung wurde nur die Reaktion auf den ersten Blaulichtpuls berücksichtigt, da beim zweiten Puls viele Pflanzen bereits nicht mehr wuchsen. An fünf nicht behandelten Kontrollpflanzen wurde nochmals der zeitliche Verlauf der phototropen Reaktion untersucht[4]: Nach einer Latenzzeit von durchschnittlich 28 Minuten begannen die Pflanzen, sich zur Blaulichtquelle hin zu krümmen. Dabei krümmte sich zunächst der oberste Teil des Hypokotyls, danach auch weiter unten liegende Hypokotylteile. 144 Minuten nach Beginn des Blaulichtpulses begannen die oberen Hypokotylteile, sich wieder ein wenig aufzurichten. Diese Aufwärtsbewegung hielt bis 232 Minuten nach Blaulichtbeginn an. Danach begannen die Pflanzen, sich wieder etwas stärker auf die Lichtquelle hin auszurichten. Nach 244 Minuten endete der Blaulichtpuls und die Beleuchtung von oben wurde wieder eingeschaltet. Zu diesem Zeitpunkt waren die Keimlinge noch dabei, sich wieder stärker auf die Blaulichtquelle auszurichten. Bereits 16 Minuten nach Ende des Blaulichtpulses begannen die Pflanzen, sich wieder aufzurichten. Es dauerte durchschnittlich 72 Minuten, bis sich die Keimlinge wieder vollständig aufgerichtet hatten. In Abbildung 3-47 wird die starke Reaktion einer Kontrollpflanze auf den ersten Blaulichtpuls dargestellt. Im Zeitverlaufsbild der Verschiebung wird rasch eine Sättigung der blauen Markierfarbe erreicht, so dass die Stärke der Krümmung anhand der Färbung nicht mehr abgeschätzt werden kann. Eine Eigenschaft der Auswertesoftware besteht jedoch darin, bei Krümmungen oder Verschiebungen, die einen gewissen Wert überschreiten, die Stängelerkennung abzuschalten. Dadurch werden mit fortschreitender Krümmung nach Beginn des ersten Blaulichtpulses die obersten Teile der scans schwarz dargestellt. Der blaue Bereich bekommt eine Delle. Ab dem Zeitpunkt, von dem an sich die Pflanze wieder ein wenig aufrichtet bzw. die Krümmung etwas nachlässt, steigt der blaue Bereich auch wieder nach oben. Diese Schwelle reagiert sehr empfindlich und wurde neben der Betrachtung der Originalaufnahmen für die Analyse des zeitlichen Verlaufs der phototropen Reaktion benutzt. In Abbildung 3-48 wird der typische Verlauf der phototropen Reaktion von Arabidopsis thaliana, Stamm C24 bei fünf Versuchspflanzen dargestellt.
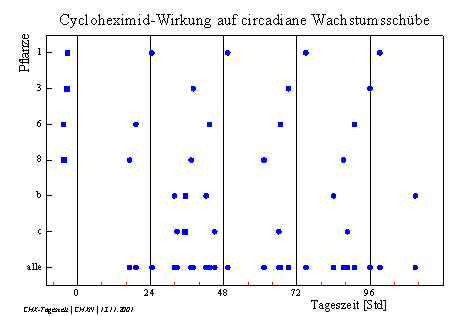
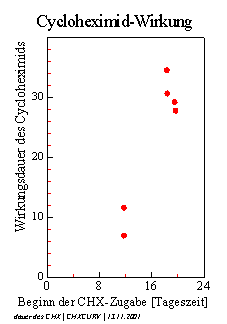
Das Wachstum von Arabidopsis thaliana und Cardaminopsis arenosa verläuft im Licht-Dunkel-Wechsel in tagesperiodischen Schüben (Abbildung 3-49). Die diurnalen Wachstumsschübe von Arabidopsis thaliana sind deutlicher abgegrenzt als bei Cardaminopsis arenosa. Bei Arabidopsis thaliana wechseln sich Wachstumsphasen, in denen meist auch Circumnutationen auftreten, mit Phasen fast ohne Wachstum und ohne Schwingungen ab. Cardaminopsis arenosa zeigt in der Regel keine völlig wachstumsfreien Phasen. Hier folgen Zeiten mit hoher Wachstumsgeschwindigkeit auf Zeiten geringen Wachstums. Circumnutationen können sowohl bei starkem als auch bei geringerem Wachstum beobachtet werden, treten jedoch in Phasen starken Wachstums vermehrt auf. Im LD beginnen die Wachstumsschübe von Arabidopsis thaliana beziehungsweise die Phasen stärkeren Wachstums von Cardaminopsis arenosa meist mit dem Beginn der Lichtphase. Bei sehr jungen Keimlingen von Cardaminopsis arenosa steigt die Wachstumsgeschwindigkeit häufig schon einige Stunden vor Lichtbeginn an. Die Applikation von 1 bis 2 µl einer 100 µM bis 1 mM Cycloheximidlösung am oberen Hypokotyl von Cardaminopsis arenosa führte innerhalb von 30 bis 60 Minuten meist zu einem völligen Wachstumsstop, der einige Stunden bis zu einem Tag dauerte. Nach Applikation am unteren Hypokotyl in der nicht mehr wachsenden Region ging das Wachstum im oberen Teil weiter. Auch wenn der Tropfen an den Kotyledonen angebracht wurde, wuchsen die Keimlinge meist weiter. 1 µl einer 10 µM Cycloheximidlösung hatte bei Applikation am oberen Hypokotyl keinen wahrnehmbaren Effekt auf das Wachstum. Abbildung 3-51 zeigt einen Versuch mit Cardaminopsis arenosa im Licht-Dunkel-Wechsel (Dunkelperioden von 24:00 Uhr bis 8:00 Uhr). Der erste Wachstumsschub begann gegen 6:00 Uhr am zweiten Versuchstag. Das Wachstum war mit dem LD synchronisiert. Applikation von 1 µl einer 1 mM CHX-Lösung um 15:28 Uhr am zweiten Versuchstag führte nach einer Stunde zu einem 12stündigen Wachstumsstop. Die folgenden drei Wachstumsschübe begannen nicht synchron mit dem Licht-Dunkel-Wechsel. Erst am fünften Versuchstag war das Wachstum anscheinend wieder mit dem LD synchronisiert. Um die Wirkung von Cycloheximid auf die Phasenlage der Wachstumsschübe zu untersuchen, wurden je 1µl einer 100µM CHX-Lösung am oberen Hypokotyl von Cardaminopsis arenosa Keimlingen appliziert. Keimung und Anzucht war im LD erfolgt (Lichtperiode von 08:00 Uhr bis 24:00 Uhr), mit dem das Wachstum der Pflanzen synchronisiert war. Während des Versuchs wurden sie im schwachen Dauerlicht gehalten. Der Versuch wurde mit Cardaminopsis arenosa durchgeführt, da hier Wachstumsschübe über längere Zeit zu beobachten sind als bei Arabidopsis thaliana. Um das Wachstum möglichst lange beobachten zu können, wurden die Pflanzen, als sie aus dem Bild herauszuwachsen begannen, einige Millimeter tiefer gesetzt. Danach wurde die Registrierung neu gestartet und der obere, wachsende Teil der Pflanzen wurde weiter aufgenommen. Die beiden Zeitverlaufsbilder wurden anschließend am Bildschirm zusammengesetzt. In Abbildung 3-53 werden die Zeitpunkte der CHX-Applikation und der Beginn der circadianen Wachstumsschübe nach der Applikation bei sechs Versuchspflanzen dargestellt.
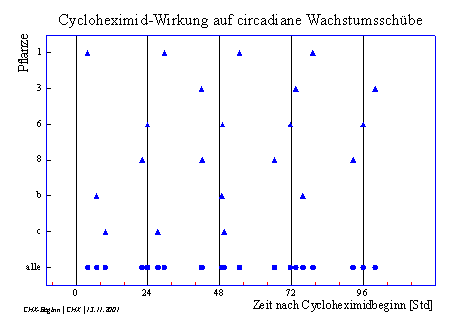
In Abbildung 3-54 wird der Beginn der circadianen Wachstumsschübe (markiert durch Dreiecke) auf den Beginn der Cycloheximid-Zugabe bezogen.
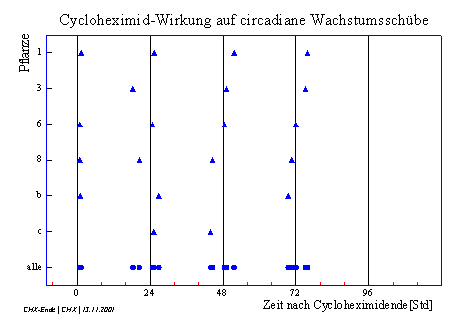
Abbildung 3-55 zeigt den Beginn der circadianen Wachstumsschübe, bezogen auf das Ende der Cycloheximid-Zugabe.
Diese Darstellung lässt vermuten, dass
die Phasenlage der circadianen Wachstumsschübe nach Cycloheximidbehandlung
durch das Ende der CHX-Wirkung bestimmt wird. [1] 1,75 – 2 µmol m-2 s-1 [2] Zubereitung der Lösungen siehe 2.3 [3] Osram, L18 W/25 universal white Leuchtstoffröhre mit Röhm und Haas Blaulichtfilter [4] Vergleiche 3.3.2.1 Circadiane Modulation der phototropen Reaktion |
|
© copyright Andreas Neugebauer 2002 Optimiert für Microsoft Internet Explorer und Netscape Version 6 |
||